题目内容
在反应4HCl+MnO2=MnCl2+Cl2↑+2H2O中,若有43.5g MnO2被还原,①则转移的电子数为 个,②被氧化的HCl的质量是 g,③生成的Cl2在标准状况下的体积是 ,④假设反应后所得溶液的体积为100mL,则所含MnCl2的物质的量浓度是 .
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:MnO2+4HCl=MnCl2+Cl2+2H2O,该反应中元素的化合价变化为:MnO2→MnCl2,Mn元素由+4价→+2价,得电子,所以MnO2氧化剂;HCl→Cl2,Cl元素由-1价→0价,失电子,所以HCl是还原剂,n(MnO2)=
=0.5mol,结合元素的化合价变化及反应方程式计算.
| 43.5g |
| 87g/mol |
解答:
解:①n(MnO2)=
=0.5mol,转移电子数为0.5mol×(4-2)×NA=NA,故答案为:NA;
②0.5mo氧化剂与1molHCl失去电子相等,则被氧化的HCl为1mol,其质量为1mol×36.5g/mol=36.5g,故答案为:36.5;
③由Cl原子守恒可知,1molHCl被氧化生成0.5molCl2,标准状况下的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2L;
④n(MnO2)=n(MnCl2)=0.5mol,则所含MnCl2的物质的量浓度是
=5mol/L,故答案为:5mol/L.
| 43.5g |
| 87g/mol |
②0.5mo氧化剂与1molHCl失去电子相等,则被氧化的HCl为1mol,其质量为1mol×36.5g/mol=36.5g,故答案为:36.5;
③由Cl原子守恒可知,1molHCl被氧化生成0.5molCl2,标准状况下的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2L;
④n(MnO2)=n(MnCl2)=0.5mol,则所含MnCl2的物质的量浓度是
| 0.5mol |
| 0.1L |
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及守恒法应用为解答的关键,侧重分析与计算能力的综合考查,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
住宅或商场等地发生火灾,消防人员用高压水枪灭火,水在灭火中的主要作用是( )
| A、降低可燃物的着火点 |
| B、使大火隔绝空气中的氧气 |
| C、降低温度到燃烧物着火点以下 |
| D、水分解出不能助燃的气体 |
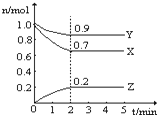 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: