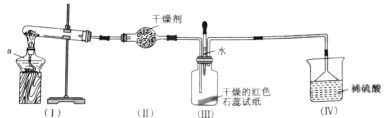
题目内容
【题目】实验室模拟用![]() 溶液和
溶液和![]() 溶液混合制备
溶液混合制备![]() ,再将所得
,再将所得![]() 与
与![]() 溶液混合,可制备草酸合铜酸钾晶体
溶液混合,可制备草酸合铜酸钾晶体![]() 。通过下述实验确定该晶体的组成。
。通过下述实验确定该晶体的组成。
步骤Ⅰ 称取![]() 样品,放入锥形瓶,加入适量
样品,放入锥形瓶,加入适量![]() 稀硫酸,微热使样品溶解,再加入
稀硫酸,微热使样品溶解,再加入![]() 水加热,用
水加热,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液。
溶液。
步骤Ⅱ 将步骤Ⅰ的溶液充分加热,使淡紫红色消失,溶液最终显示蓝色。冷却后,调节![]() 并加入过量
并加入过量![]() 固体,与
固体,与![]() 反应生成
反应生成![]() 沉淀和
沉淀和![]() ,以淀粉作指示剂,用
,以淀粉作指示剂,用![]() 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗![]() 标准溶液。
标准溶液。
已知:![]() ;
;
![]() ;
;![]()
回答下列问题:
(1)室温下,![]() ,
,![]() ,
,![]() 溶液
溶液![]() ________7(填“>”或“<”或“=”)。
________7(填“>”或“<”或“=”)。
(2)步骤Ⅱ中滴定终点的现象为________。
(3)步骤Ⅱ中若消耗的![]() 标准溶液的体积偏大,可能的原因有________(填字母)。
标准溶液的体积偏大,可能的原因有________(填字母)。
A.滴定前未将待测溶液充分加热
B.锥形瓶水洗后未干燥
C.装![]() 标准溶液的滴定管水洗后未润洗
标准溶液的滴定管水洗后未润洗
D.滴定时锥形瓶中有液体溅出
(4)通过计算确定该晶体的化学式(写出计算过程)。
________________________
【答案】< 溶液由蓝色恰好变为无色,且30秒内不变色 AC ![]()
【解析】
根据KHCO3溶液中存在电离平衡和水解平衡,由电离常数和水解常数判断相对大小,进而判断溶液的酸碱性;根据滴定原理,结合I2使淀粉变蓝,判断滴定终点现象;根据氧化还原滴定,由![]() 反应,分析消耗的
反应,分析消耗的![]() 标准溶液的体积偏大的原因;根据题中所给数据,结合氧化还原反应,由得失电子守恒计算该晶体的化学式。
标准溶液的体积偏大的原因;根据题中所给数据,结合氧化还原反应,由得失电子守恒计算该晶体的化学式。
(1)![]() 溶液中存在HC2O4-
溶液中存在HC2O4-![]() H++C2O42-电离平衡,Ka2=
H++C2O42-电离平衡,Ka2=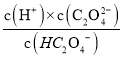 =5.4×10-5,KHC2O4水解反应为:HC2O4-+H2OH2C2O4+OH-,其水解平衡常数为Kh2=
=5.4×10-5,KHC2O4水解反应为:HC2O4-+H2OH2C2O4+OH-,其水解平衡常数为Kh2=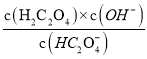 =
=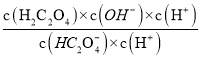 =
=![]() =
=![]() =1.9×10-13,在KHC2O4溶液中,HC2O4-电离呈酸性,HC2O4-水解呈碱性,由Ka2=5.4×10-5>Kh2=1.9×10-13可知,电离程度大于水解程度,故KHC2O4溶液呈酸性,pH<7,答案为<。
=1.9×10-13,在KHC2O4溶液中,HC2O4-电离呈酸性,HC2O4-水解呈碱性,由Ka2=5.4×10-5>Kh2=1.9×10-13可知,电离程度大于水解程度,故KHC2O4溶液呈酸性,pH<7,答案为<。
(2)步骤II化学反应是![]() ;
;![]() ,用
,用![]() 标准溶液滴定I2,淀粉作指示剂,开始呈现蓝色,滴定到终点,现象为加入最后一滴Na2S2O3的标准液于锥形瓶中,溶液由蓝色恰好变为无色,且30s不恢复;答案为加入最后一滴Na2S2O3的标准液于锥形瓶中,溶液由蓝色恰好变为无色,且30s不恢复。
标准溶液滴定I2,淀粉作指示剂,开始呈现蓝色,滴定到终点,现象为加入最后一滴Na2S2O3的标准液于锥形瓶中,溶液由蓝色恰好变为无色,且30s不恢复;答案为加入最后一滴Na2S2O3的标准液于锥形瓶中,溶液由蓝色恰好变为无色,且30s不恢复。
(3)A.滴定前未将待测溶液充分加热,待测溶液中可能含有MnO4-,高锰酸根离子能够氧化碘离子,使得碘单质的物质的量增加,消耗更多的Na2S2O3,消耗的![]() 标准溶液的体积偏大,故A符合题意;
标准溶液的体积偏大,故A符合题意;
B.锥形瓶水洗后未干燥,不影响滴定,对滴定结果无影响,故B不符合题意;
C.装![]() 标准溶液的滴定管水洗后未润洗,标准液被稀释,滴定时消耗的体积增大,故C符合题意;
标准溶液的滴定管水洗后未润洗,标准液被稀释,滴定时消耗的体积增大,故C符合题意;
D.滴定时锥形瓶中有液体溅出,待测液损失,标准液消耗量减小,消耗![]() 标准溶液的体积变小,故D不符合题意;
标准溶液的体积变小,故D不符合题意;
答案AC。
(4)由![]() 反应可知,C2O4-与MnO4-完全反应,消耗
反应可知,C2O4-与MnO4-完全反应,消耗![]() ×3.2×10-3mol=8.0×10-3mol,由
×3.2×10-3mol=8.0×10-3mol,由![]() ,
,![]() 可知,关系式为2S2O32-~I2~2Cu2+,得出n(Cu2+)=n(S2O32-)=0.2500mol·L-1×0.016L=4.0×10-3mol,根据电荷守恒原理:n(K+)=2n(S2O32-)-2n(Cu2+)=2×8.0×10-3mol-2×4.0×10-3mol=8.0×10-3mol,根据质量守恒原理:m(H2O)=1.4160g-8.0×10-3mol×39g/mol-4.0×10-3mol×64g/mol-8.0×10-3mol×88g/mol=1.4160g-0.312g-0.256g-0.704g=0.144g,n(H2O)=
可知,关系式为2S2O32-~I2~2Cu2+,得出n(Cu2+)=n(S2O32-)=0.2500mol·L-1×0.016L=4.0×10-3mol,根据电荷守恒原理:n(K+)=2n(S2O32-)-2n(Cu2+)=2×8.0×10-3mol-2×4.0×10-3mol=8.0×10-3mol,根据质量守恒原理:m(H2O)=1.4160g-8.0×10-3mol×39g/mol-4.0×10-3mol×64g/mol-8.0×10-3mol×88g/mol=1.4160g-0.312g-0.256g-0.704g=0.144g,n(H2O)=![]() =8×10-3mol,则n(K+):n(Cu2+):n(C2O42-):n(H2O)= 8.0×10-3:4.0×10-3:8.0×10-3:8×10-3=2:1:2:2,该晶体的化学式为K2Cu(C2O4)2·2H2O;答案为K2Cu(C2O4)2·2H2O。
=8×10-3mol,则n(K+):n(Cu2+):n(C2O42-):n(H2O)= 8.0×10-3:4.0×10-3:8.0×10-3:8×10-3=2:1:2:2,该晶体的化学式为K2Cu(C2O4)2·2H2O;答案为K2Cu(C2O4)2·2H2O。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
【题目】用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如下:
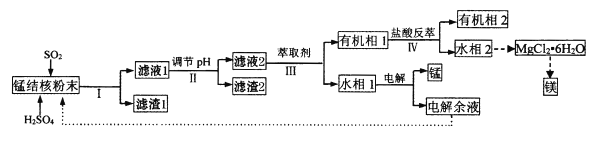
已知:①几种难溶物的溶度积(25℃)如下表所示:
化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
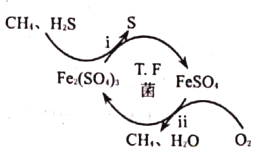
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为_____。
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为_______,“滤渣2”的成分为______。
(3)“Ⅲ”处“萃取剂”萃取的成分是___;“Ⅳ”处用“盐酸反萃”的作用是____。
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为__________。
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为____。
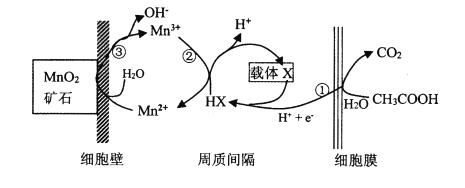
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式____________。