题目内容
下列配制的溶液浓度偏高的是( )
| A、配制盐酸溶液用量筒量取盐酸时俯视刻度线 |
| B、浓H2SO4稀释后未经冷却即注入容量瓶配制 |
| C、配制100mL1mol/L Na2CO3溶液时,砝码放在托盘天平左盘 |
| D、配制盐酸溶液定容时,仰视容量瓶刻度线 |
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
| n |
| V |
解答:
解:A.配制盐酸溶液用量筒量取盐酸时俯视刻度线,导致量取的盐酸的体积偏小,配制的溶液中氯化氢的物质的量偏小,根据c=
可得,溶液浓度偏低,故A错误;
B.热的溶液体积偏大,冷却后溶液体积变小,若浓硫酸稀释后没有冷却就转移到容量瓶中,会导致配制的溶液体积偏小,根据c=
可得,溶液的浓度偏高,故B正确;
C.砝码与药品放颠倒,会导致称量的碳酸钠的质量偏小,配制的溶液中溶质的物质的量偏小,根据c=
可得,溶液的浓度偏低,故C错误;
D.定容时仰视定容,会导致加入的蒸馏水超过容量瓶刻度线,配制的溶液体积偏大,根据c=
可得,溶液的浓度偏小,故D错误;
故选B.
| n |
| V |
B.热的溶液体积偏大,冷却后溶液体积变小,若浓硫酸稀释后没有冷却就转移到容量瓶中,会导致配制的溶液体积偏小,根据c=
| n |
| V |
C.砝码与药品放颠倒,会导致称量的碳酸钠的质量偏小,配制的溶液中溶质的物质的量偏小,根据c=
| n |
| V |
D.定容时仰视定容,会导致加入的蒸馏水超过容量瓶刻度线,配制的溶液体积偏大,根据c=
| n |
| V |
故选B.
点评:本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,试题基础性强,贴近高考,该题难易适中,注重灵活性,注意明确误差分析的方法,试题有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

练习册系列答案
相关题目
下列实验方案能顺利达到实验目的是( )
A、 排空气法收集NO |
B、 乙醇萃取碘水中碘 |
C、 过滤 |
D、 量取9.3mLH2O |
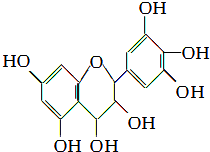 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )| A、该物质既可看作醇类,也可看作酚类 |
| B、1 mol该物质可与4 mol Br2反应 |
| C、1 mol该物质可与7 mol NaOH反应 |
| D、1 mol该物质可与7 mol Na反应 |
下列做法不能体现低碳生活的是( )
| A、减少食品加工环节 |
| B、注意节约用电 |
| C、尽量购买本地、当季的食物 |
| D、焚烧废纸减少垃圾 |
由乙烯推测丙烯的结构或性质正确的是( )
| A、分子中3个碳原子在同一直线上 |
| B、能使酸性KMnO4溶液褪色 |
| C、分子中所有原子在同一平面上 |
| D、与氯化氢加成只生成一种产物 |
下列化学反应的离子方程式书写正确的是( )
| A、氯化铝溶液与过量氨水反应:3OH-+Al3+═Al(OH)3↓ |
| B、铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| C、FeCl3溶液与Cu粉反应:Cu+Fe3+═Cu2++Fe2+ |
| D、次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
 用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )
用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )