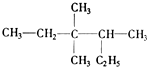
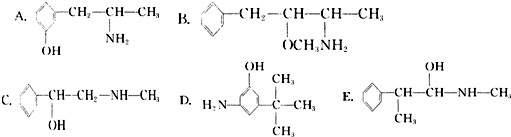
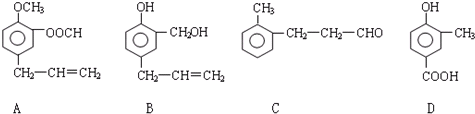
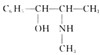题目内容
某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g.
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是Al3+和 ,阴离子是 .
(2)试通过计算确定:n(Al3+)= ;该结晶水合物的化学式 .
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol?L-1.
①加入 mLBa(OH)2溶液时,所得沉淀的总物质的量最大.
②请在如图中画出生成沉淀的物质的量与加入Ba(OH)2溶液体积的关系示意图.

请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是Al3+和
(2)试通过计算确定:n(Al3+)=
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol?L-1.
①加入
②请在如图中画出生成沉淀的物质的量与加入Ba(OH)2溶液体积的关系示意图.

考点:化学方程式的有关计算
专题:计算题
分析:(1)能使湿润的红色石蕊试纸变蓝的气体是氨气,证明铵根离子的存在,白色溶于氢氧化钠的沉淀是氢氧化铝,和Ba(OH)2溶液反应生成的白色不溶于硝酸的白色沉淀是硫酸钡;
(2)根据电荷守恒和原子守恒来计算回答;
(3)开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,后发生Al(OH)3+OH-=AlO2-+2H2O,NH4++OH-=NH3?H2O,根据物质反应的先后顺序确定离子反应并画出生成沉淀的物质的量与加入Ba(OH)2溶液体积的关系示意图.
(2)根据电荷守恒和原子守恒来计算回答;
(3)开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,后发生Al(OH)3+OH-=AlO2-+2H2O,NH4++OH-=NH3?H2O,根据物质反应的先后顺序确定离子反应并画出生成沉淀的物质的量与加入Ba(OH)2溶液体积的关系示意图.
解答:
解:(1)一份加入足量Ba(OH)2溶液,生成白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g,说明含有硫酸根离子;加入NaOH溶液,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,该气体是氨气,证明一定含有铵根离子;向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,最后白色沉淀逐渐减少并最终消失,证明一定含有铝离子,
故答案为:NH4+;SO42-;
(2)由题中信息可知45.3g的该结晶水合物中:n(SO42-)=
=0.2mol,n(NH4+)=
=0.1 mol,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42-)可得:n(Al3+)=
×(2×0.2mol-0.1 mol)=0.1 mol,n(H2O)=
=1.2mol,该结晶水合物中:n(NH4+):n(Al3+):n(SO42-):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,所以,该结晶水合物的化学式为NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O],
故答案为:0.1mol;NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O];
(3)①根据反应的先后顺序,开始阶段是氢氧化钡和铝离子反应生成氢氧化铝沉淀阶段,然后是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧化钡反应生成偏铝酸钡的阶段,当NH4Al(SO4)2?12H2O和氢氧化钡的物质的量之比为1:2时,两者恰好反应生成硫酸钡、氢氧化铝和一水合氨,此时生成沉淀量最大,离子反应方程式为:NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O,n(Al3+)=
×(2×0.2mol-0.1 mol)=0.1 mol,则n[Ba(OH)2]=2×0.1 mol=0.2mol,v=
=
=0.1L=100mL,
故答案为:100;
②45.3g的该结晶水合物中:含有SO42-、NH4+、Al3+,其物质的量分别为:0.2mol、0.1mol、0.1mol,根据反应的先后顺序,开始阶段是SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,SO42-未完全沉淀,然后是SO42-完全沉淀,再次是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧根离子反应生成偏铝酸根离子的阶段,结合SO42-~Ba2+~BaSO4↓,Al3+~3OH-~Al(OH)3↓,
Al3+完全沉淀,需氢氧化钡0.15mol,体积为75mL,沉淀为氢氧化铝和部分硫酸钡共0.25mol;SO42-完全沉淀,需氢氧化钡0.2mol,体积为100mL,沉淀为氢氧化铝和全部硫酸钡共0.3mol;
Al(OH)3↓~OH-~[Al(OH)4]-,氢氧化铝溶解需0.05mol氢氧化钡,体积为125mL,沉淀为全部硫酸钡0.2mol;最后为NH4+~OH-,0.1molNH4+、需0.05mol氢氧化钡,体积为150mL,所以图象为: ,
,
故答案为: .
.
故答案为:NH4+;SO42-;
(2)由题中信息可知45.3g的该结晶水合物中:n(SO42-)=
| 46.6g |
| 233g/mol |
| 2.24L |
| 22.4L/mol |
| 1 |
| 3 |
| 45.3g-0.1mol×27g/mol-0.1mol×18g/mol-0.2mol×96g/mol |
| 18g/mol |
故答案为:0.1mol;NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O];
(3)①根据反应的先后顺序,开始阶段是氢氧化钡和铝离子反应生成氢氧化铝沉淀阶段,然后是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧化钡反应生成偏铝酸钡的阶段,当NH4Al(SO4)2?12H2O和氢氧化钡的物质的量之比为1:2时,两者恰好反应生成硫酸钡、氢氧化铝和一水合氨,此时生成沉淀量最大,离子反应方程式为:NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O,n(Al3+)=
| 1 |
| 3 |
| n |
| c |
| 0.2mol |
| 2mol/L |
故答案为:100;
②45.3g的该结晶水合物中:含有SO42-、NH4+、Al3+,其物质的量分别为:0.2mol、0.1mol、0.1mol,根据反应的先后顺序,开始阶段是SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,SO42-未完全沉淀,然后是SO42-完全沉淀,再次是铵根离子和氢氧根离子反应生成氨气和水的阶段,最后是氢氧化铝和氢氧根离子反应生成偏铝酸根离子的阶段,结合SO42-~Ba2+~BaSO4↓,Al3+~3OH-~Al(OH)3↓,
Al3+完全沉淀,需氢氧化钡0.15mol,体积为75mL,沉淀为氢氧化铝和部分硫酸钡共0.25mol;SO42-完全沉淀,需氢氧化钡0.2mol,体积为100mL,沉淀为氢氧化铝和全部硫酸钡共0.3mol;
Al(OH)3↓~OH-~[Al(OH)4]-,氢氧化铝溶解需0.05mol氢氧化钡,体积为125mL,沉淀为全部硫酸钡0.2mol;最后为NH4+~OH-,0.1molNH4+、需0.05mol氢氧化钡,体积为150mL,所以图象为:
 ,
,故答案为:
 .
.
点评:本题考查离子的检验和推断、离子方程式的书写,题目难度中等,侧重对学生能力的培养和解题方法的训练与指导,有利于培养学生的逻辑思维能力和发散思维能力,注意从守恒的角度推断结晶水合物的化学式,注意掌握离子方程式的书写原则,明确离子反应先后顺序、正确判断反应物离子的过量情况是书写离子方程式的关键.

练习册系列答案
相关题目
下列关于物质性质与应用的说法正确的是( )
| A、碳具有还原性,高温条件下能将二氧化硅还原为硅 |
| B、二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 |
| C、二氧化硅是半导体材料,可将太阳能直接转化为电能 |
| D、二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂 |

 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.