题目内容
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO(g)+H2O(g)
 CO2(g)+H2(g)。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2(g)+H2(g)。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )| A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 |
| B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 |
| C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 molH2 |
| D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |
B
A、采用极限分析法,0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:1.5mol:3mol=1:2,反应前后气体体积不变,平衡相同,CO的体积分数为x,A不正确;
B、采用极限分析法,1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2,假如反应完全转化为CO和H2O物质的量为:2mol:2mol=1:1,反应前后气体体积不变,平衡正向进行,CO的体积分数大于x,B符合;
C、采用极限分析法,0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2,假如反应完全转化为CO和H2O物质的量为:0.9mol:l.9mol=9:19,反应前后气体体积不变,平衡相同,CO的体积分数为x,C不正确;
D、采用极限分析法,0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mo H2,假如反应完全转化为CO和H2O物质的量为1mol:2mol=1:2,当反应达到平衡时,CO的体积分数为x.D不正确;
选B.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表 :
:
 >
> ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。 4Y(g) +Z(g) △H < 0,在某温度时X的浓度随时间变化的曲线:
4Y(g) +Z(g) △H < 0,在某温度时X的浓度随时间变化的曲线: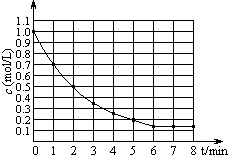
 C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )
C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )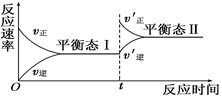
 2C(g) ,下列叙述中是反应达到平衡的标志的是( )
2C(g) ,下列叙述中是反应达到平衡的标志的是( ) CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: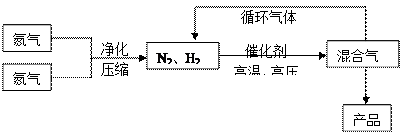
 95.79
95.79 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍