题目内容
19.若将12.8g铜与一定量的浓硝酸反应,铜耗完时,共产生气体(NO和NO2的混合物)5.6L(标准状况).则所消耗的硝酸的物质的量为0.65mol,所得气体的平均相对分子量为41.2.分析 12.8gCu的物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol,根据得失电子守恒n(NO2)+3n(NO)=2n(Cu)=0.4,而n(NO2)+n(NO)=0.25mol,解之得n(NO2)=0.175mol,计算一氧化氮的物质的量进而求其相对分子质量.
解答 解:12.8gCu的物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol,根据得失电子守恒n(NO2)+3n(NO)=2n(Cu)=0.4,而n(NO2)+n(NO)=0.25mol,解之得n(NO2)=0.175mol,n(NO)=0.075mol,混合气体平均分子摩尔质量=$\frac{0.075×30+0.175×46}{0.25}$=41.2g/mol,所以混合气体平均相对分子质量为41.2,故答案为:0.65mol;41.2.
点评 本题以硝酸和Cu的反应为载体考查氧化还原反应计算等知识点,为高频考点,侧重考查学生分析判断及计算能力,题目难度不大.

练习册系列答案
相关题目
10.下列不能和铁发生反应的是( )
| A. | H+ | B. | OH- | C. | Fe3+ | D. | 氯水 |
7. 美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
 美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 1mol该有机物完全燃烧需消耗25molO2 | |
| C. | 1mol该有机物最多可以和10molH2发生加成反应 | |
| D. | 该有机物的一氯代产物的同分异构体有12种 |
4.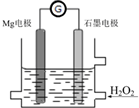 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 镁电极是该电池的负极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-═Mg2+ | |
| D. | 电池工作时,电子从石墨电极经导线流向Mg电极,溶液中阳离子流向正极 |
11.一定温度下,可逆反应A2(g)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时生成3mol B2 | |
| C. | 容积一定时,容器内气体密度保持不变 | |
| D. | 容器内A2、B2、AB3的物质的量浓度相等 |
9.化学知识广泛应用于生产、生活中,下列叙述不正确的是( )
| A. | 研发可降解高分子材料,减少“白色污染” | |
| B. | 明矾和ClO2都能作为净水剂,其原理完全相同 | |
| C. | 海水淡化和工业生产及生活废水的再生利用,是解决缺水问题的有效途径 | |
| D. | 液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰 |

 ,反应类型:加聚反应(或聚合反应)
,反应类型:加聚反应(或聚合反应) 反应类型:取代反应
反应类型:取代反应