题目内容
13.相同质量的下列气体中,所含原子数最多的是( )| A. | C2H6 | B. | N2 | C. | CO | D. | O2 |
分析 假设各物质的量的质量为1g,根据m=$\frac{m}{M}$计算各物质的物质的量,再结合分子含有原子数目计算含有原子总物质的量.
解答 解:假设各物质的量的质量为1g,则:
C2H6的物质的量为$\frac{1}{30}$mol,含有原子总物质的量为$\frac{1}{30}$mol×8=0.267mol;
N2的物质的量为$\frac{1}{28}$mol,含有原子总物质的量为$\frac{1}{28}$mol×2=0.071mol;
CO的物质的量为$\frac{1}{28}$mol,含有原子总物质的量为$\frac{1}{28}$mol×2=0.071mol;
O2原子总物质的量为$\frac{1}{16}$mol=0.625mol,
故原子数最多的是A,
故选A.
点评 本题考查物质的量有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列电子式中错误的是( )
| A. | Na+ | B. | 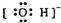 | C. | 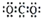 | D. | 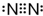 |
1.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下.

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、A13+、Ca2+和Mg2+.
(1)酸浸时,为了提高浸取率可采取的措施有升高反应温度;增大固体颗粒的表面积(答出两点).
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:2Cr3++3H2O2+H2O=Cr2O72-+8H+.
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.滤液II中阳离子主要有Na+、Mg2+、Ca2+;
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液II中的金属阳离子是Ca2+、Mg2+.
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH.

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、A13+、Ca2+和Mg2+.
(1)酸浸时,为了提高浸取率可采取的措施有升高反应温度;增大固体颗粒的表面积(答出两点).
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:2Cr3++3H2O2+H2O=Cr2O72-+8H+.
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液II中的金属阳离子是Ca2+、Mg2+.
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH.
18.下列有关元素性质的递变规律不正确的是( )
| A. | Na、Mg、Al的还原性逐渐减弱 | |
| B. | HCl、H2S、PH3、气态氢化物的稳定性逐渐增强 | |
| C. | NaOH、KOH的碱性逐渐增强 | |
| D. | O的原子半径比S的原子半径大 |

 .
.