题目内容
碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业.下列与碳酸钠有关的说法正确的是( )
| A、Na2CO3的稳定性介于Na2CO3?10H2O和NaHCO3之间 | B、“侯氏制碱法”制得的碱是指NaHCO3 | C、可用盐酸鉴别Na2CO3 和NaHCO3固体 | D、纯碱有时可代替烧碱使用,比如溶解石英、促进乙酸乙酯的水解等 |
分析:A.Na2CO3的稳定性大于Na2CO3?10H2O和NaHCO3;
B.“侯氏制碱法”制得的碱是指Na2CO3;
C.盐酸和Na2CO3、碳酸氢钠反应方程式分别为:Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O;
D.Na2CO3为强碱弱酸盐,其溶液呈碱性,但较微弱,不能溶解二氧化硅、不能促进乙酸乙酯水解.
B.“侯氏制碱法”制得的碱是指Na2CO3;
C.盐酸和Na2CO3、碳酸氢钠反应方程式分别为:Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O;
D.Na2CO3为强碱弱酸盐,其溶液呈碱性,但较微弱,不能溶解二氧化硅、不能促进乙酸乙酯水解.
解答:解:A.常温下,Na2CO3?10H2O能风化生成Na2CO3,加热条件下NaHCO3分解生成Na2CO3,所以Na2CO3的稳定性大于Na2CO3?10H2O和NaHCO3,故A错误;
B.“侯氏制碱法”制得的碱是指Na2CO3,Na2CO3为强碱弱酸盐,碳酸根离子水解导致其溶液呈碱性,故B错误;
C.盐酸和Na2CO3、NaHCO3反应方程式分别为:Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O,所以向Na2CO3、NaHCO3溶液中滴加稀盐酸反应现象不同,Na2CO3溶液中先没有气体生成,一段时间后产生气体,NaHCO3溶液中立即产生气体,所以可以用稀盐酸鉴别Na2CO3、NaHCO3,故C正确;
D.Na2CO3为强碱弱酸盐,其溶液呈碱性,但较微弱,Na2CO3溶液的碱性不能溶解二氧化硅,也不能促进乙酸乙酯水解,所以实验室用饱和的Na2CO3溶液分离、提纯乙酸乙酯,故D错误;
故选C.
B.“侯氏制碱法”制得的碱是指Na2CO3,Na2CO3为强碱弱酸盐,碳酸根离子水解导致其溶液呈碱性,故B错误;
C.盐酸和Na2CO3、NaHCO3反应方程式分别为:Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2↑+H2O,所以向Na2CO3、NaHCO3溶液中滴加稀盐酸反应现象不同,Na2CO3溶液中先没有气体生成,一段时间后产生气体,NaHCO3溶液中立即产生气体,所以可以用稀盐酸鉴别Na2CO3、NaHCO3,故C正确;
D.Na2CO3为强碱弱酸盐,其溶液呈碱性,但较微弱,Na2CO3溶液的碱性不能溶解二氧化硅,也不能促进乙酸乙酯水解,所以实验室用饱和的Na2CO3溶液分离、提纯乙酸乙酯,故D错误;
故选C.
点评:本题考查了碳酸钠的有关知识,根据教材中碳酸钠、碳酸氢钠稳定性强弱等知识点来分析解答,知道除去碳酸钠中碳酸氢钠的方法、除去碳酸氢钠中碳酸钠的方法,知道实验室制取乙酸乙酯时饱和碳酸钠溶液的作用,题目难度不大.

练习册系列答案
相关题目
过碳酸钠(2Na2CO3?3H2O2)在生产和生活领域应用广泛,其制备反应为:2Na2CO3(aq)+3H2O2?2Na2CO3?3H2O2(s)△H<0.过碳酸钠具有Na2CO3和H2O2的双重性质,在50℃时分解为碳酸钠和过氧化氢.下列有关说法错误的是( )
| A、实验室制备过碳酸钠时可釆用冷水浴控制反应温度 | B、过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂 | C、过碳酸钠应密封保存,放置于冷暗处 | D、过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体 |
下列关于碳酸氢钠(NaHCO3)和碳酸钠(Na2CO3)的叙述中,不正确的是( )
| A、均可溶于水 | B、水溶液滴入酚酞,均能变红 | C、均能与盐酸反应 | D、受热均易分解 |
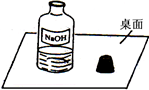 (2013?天河区一模)一天,小明走进实验室,看到了一幅“不和谐”的画面(如图).围绕此瓶试剂是否变质的问题,展开了探究.
(2013?天河区一模)一天,小明走进实验室,看到了一幅“不和谐”的画面(如图).围绕此瓶试剂是否变质的问题,展开了探究. 实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题
实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题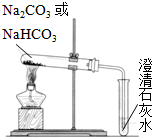 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.