题目内容
【题目】用乙醇燃料电池作为电源电解KI溶液的装置如下图所示,下列说法正确的是( )
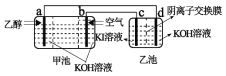
A.甲池中OH-流向b极,乙池中OH-流向c极
B.a极的电极反应方程为:CH3CH2OH-12e-+3H2O=2CO2+12H+
C.已知I2会与OH-产生IO-,则在乙池的右侧会存在IO-
D.当乙池产生2mol气体时,则线路中转移2mole-
【答案】C
【解析】
乙醇燃料电池,为原电池,a做负极,发生氧化反应,b做正极,发生还原反应;与a相连的d为电解池的阴极,发生还原反应,与b相连的c为电解池的阳极,发生氧化反应;注意两种装置的环境均为碱性环境。
A.在原电池中阴离子流向负极a极,A错误;
B.碱性环境中,电极反应方程式中不可能出现H+,且C元素的产物应为CO32-而非CO2,B错误;
C.由于乙池加的阴离子交换膜,允许阴离子自由通过,故I2和OH-反应产生IO-在左右两侧都会出现,C正确;
D.乙池产生的是H2,当产生2molH2时,转移4mol电子,D错误。
故选C。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热ΔH分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为___________________________________________;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有________。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:
2H2(g)+2CO(g)![]() CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min内用CO表示该反应的速率为_________________,随着反应的进行速率逐渐减慢的可能原因是____________________________________________________;
②150℃时该反应的平衡常数的数值约为_________;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数________,若再次通入1molH2和1molCO,则CH3COOH(g)的体积分数_________。(填“增大”“减小”或者“不变”)
(4)一定温度下,容积恒为1L的两个密闭容器之中进行如下实验:
实验编号 | 起始投料 |
① | 2molH2和2molCO |
② | 1molCH3COOH(g) |
则实验①中H2和实验②中CH3COOH的转化率随时间变化图示如下:
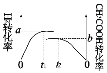
则a+b=_______,达到平衡的时间大小关系为t1__________t2。(填“>”“<”“不确定”)
【题目】氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
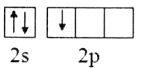
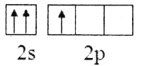
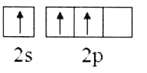
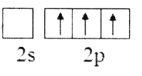
(1)基态B原子的价电子排布式为___,B、C、N、O第一电离能由大到小的顺序为___,CH4、H2O、CO2的键角按照由大到小的顺序排列为___。
(2)与(HB=NH)3互为等电子体的有机分子为___(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
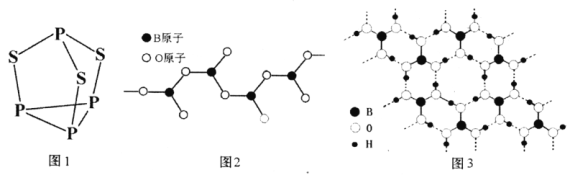
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
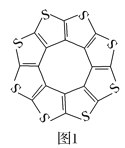
①C16S8分子中C原子和S原子的杂化轨道类型分别为___。
②相关键长数据如表所示:
化学键 | C—S | C=S | C16S8中碳硫键 |
键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是___。
③C16S8与H2微粒间的作用力是___。
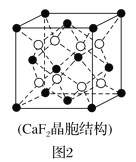
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为___。
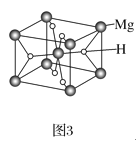
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为___cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。