题目内容
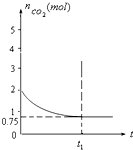 一定温度下,向1升的恒容容器中加入2moL碳和2moLCO2,反应为:
一定温度下,向1升的恒容容器中加入2moL碳和2moLCO2,反应为:C(s)+CO2(g)?2CO(g)△H>0
容器中CO2的物质的量随时间t的变化关系如图.
(1)该温度下,若t1=10min时达到平衡,此时CO2的反应速率为
(2)若温度不变,向上述平衡体系中再通入2moLCO2,CO2的转化率将
(3)该温度下,向该容器加入4moL碳和4moLCO2,达到平衡时CO2物质的量为2moL,请在图中画出容器中CO2的物质的量随时间t的变化示意图.
分析:(1)根据二氧化碳的变化量求出浓度变化,再求速率;根据平衡的浓度求出K;
(2)该反应中方向为体积增大的方向,再通入2moLCO2,体系压强增大,平衡逆移,依此分析转化率;催化剂对平衡无影响;根据温度对平衡的影响分析;体积不变充入稀有气体平衡不移动;
(3)向该容器加入4moL碳和4moLCO2,达到平衡时CO2物质的量为2moL,由于反应物浓度增大,平衡所用时间缩短,据此作图.
(2)该反应中方向为体积增大的方向,再通入2moLCO2,体系压强增大,平衡逆移,依此分析转化率;催化剂对平衡无影响;根据温度对平衡的影响分析;体积不变充入稀有气体平衡不移动;
(3)向该容器加入4moL碳和4moLCO2,达到平衡时CO2物质的量为2moL,由于反应物浓度增大,平衡所用时间缩短,据此作图.
解答:解:(1)由图象可知平衡时2moLCO2为0.75mol;
C(s)+CO2(g)?2CO(g)
初始量(mol):2 2
转化量(mol):1.25 1.25 2.5
平衡量(mol):0.75 0.75 2.5
则CO2的反应速率为:
=0.125?mol-1?L-1?min-1;平衡时各气体物质的浓度为:c(CO2)
=0.75mol/L,c(CO)=
=2.5mol/L;
所以K=
=
=8.3;
故答案为:0.125?mol-1?L-1?min-1;8.3;
(2)该反应中方向为体积增大的方向,再通入2moLCO2,体系压强增大,与原平衡比较,相当于平衡逆移,所以二氧化碳的转化率减小;催化剂对平衡无影响,所以CO2的转化率不变;已知该反应正方向为吸热反应,所以升高温度平衡正移;体积不变的容器中充入稀有气体,各反应气体的浓度不大,所以平衡不移动;
故答案为:减小;不变; 向正反应方向;不;
(3)向该容器加入4moL碳和4moLCO2,达到平衡时CO2物质的量为2moL,由于反应物浓度增大,平衡所用时间缩短,图象为: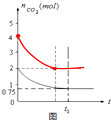 ;
;
故答案为: .
.
C(s)+CO2(g)?2CO(g)
初始量(mol):2 2
转化量(mol):1.25 1.25 2.5
平衡量(mol):0.75 0.75 2.5
则CO2的反应速率为:
| ||
| 10min |
| 0.75mol |
| 1L |
| 2.5mol |
| 1L |
所以K=
| c2(CO) |
| c(CO2) |
| 2.52 |
| 0.75 |
故答案为:0.125?mol-1?L-1?min-1;8.3;
(2)该反应中方向为体积增大的方向,再通入2moLCO2,体系压强增大,与原平衡比较,相当于平衡逆移,所以二氧化碳的转化率减小;催化剂对平衡无影响,所以CO2的转化率不变;已知该反应正方向为吸热反应,所以升高温度平衡正移;体积不变的容器中充入稀有气体,各反应气体的浓度不大,所以平衡不移动;
故答案为:减小;不变; 向正反应方向;不;
(3)向该容器加入4moL碳和4moLCO2,达到平衡时CO2物质的量为2moL,由于反应物浓度增大,平衡所用时间缩短,图象为:
 ;
;故答案为:
 .
.点评:本题考查了化学反应速率、平衡常数、化学平衡影响因素与化学平衡图象等,注意根据反应的特征分析外界条件对平衡的影响,难度中等.

练习册系列答案
相关题目

 2NH3(g),其
2NH3(g),其

 2NO(g) ΔH
2NO(g) ΔH ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。