题目内容
在一定温度下,向一容积为2L升的恒容密闭容器内加入0.2mol的N2和0.6mol的H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:
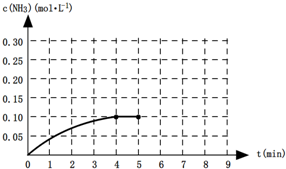
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)= .
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (选填字母编号).
a.0.20mol?L-1 b.0.16mol?L-1 c.0.10mol?L-1 d.0.05mol?L-1
(3)该反应的化学平衡常数表达式为 .反应达到平衡后,第5分钟时,若保持其它条件不变,只把容器的体积缩小一半,平衡 移动(选填“正向”、“逆向”或“不”),化学平衡常数K (选填“增大”、“减小”或“不变”).
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出从第5分钟开始变化直至到达新平衡时NH3浓度的变化曲线.
(5)常温下,向0.001mol?L-1的AlCl3 溶液中通入NH3直至过量,现象 ,当pH= 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33).

(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)=
(2)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.20mol?L-1 b.0.16mol?L-1 c.0.10mol?L-1 d.0.05mol?L-1
(3)该反应的化学平衡常数表达式为
(4)第5分钟时把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol?L-1),请在图中画出从第5分钟开始变化直至到达新平衡时NH3浓度的变化曲线.
(5)常温下,向0.001mol?L-1的AlCl3 溶液中通入NH3直至过量,现象
分析:(1)根据反应速率公式计算;
(2)根据温度对化学平衡的影响分析;
(3)根据反应方程式和化学平衡常数含义书写;根据压强对化学平衡的影响分析;根据影响化学平衡常数的因素分析;
(4)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图;
(5)AlCl3 溶液中通入NH3生成白色沉淀Al(OH)3,根据Ksp[Al(OH)3]=1.0×10-33求出氢氧根离子浓度.
(2)根据温度对化学平衡的影响分析;
(3)根据反应方程式和化学平衡常数含义书写;根据压强对化学平衡的影响分析;根据影响化学平衡常数的因素分析;
(4)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图;
(5)AlCl3 溶液中通入NH3生成白色沉淀Al(OH)3,根据Ksp[Al(OH)3]=1.0×10-33求出氢氧根离子浓度.
解答:解:(1)v=
=
=0.025 mol/(L?min),
故答案为:0.025 mol/(L?min);
(2)该反应是可逆反应,所以反应物不能完全转化为生成物,所以氨气的浓度不可能为0.20mol/L;Q>0,所以该反应是放热反应,升高温度,平衡向逆反应方向移动,降低温度,平衡向正反应方向移动,所以氨气的浓度不可能为0.10mol/L,故选ac,
故答案为:a、c;
(3)化学平衡常数K=
,该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变.
故答案为;
;正向;不变;
(4)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L.
故答案为: ;
;
(5)在AlCl3 溶液中通入NH3,应产生白色沉淀Al(OH)3.Ksp[Al(OH)3]=c(Al3+)×[c(OH-)]3代入数据,可得c(OH-)=1.0×10-10mol/L,常温下,pH=4,
故答案为:产生百色沉淀;4.
| △c |
| t |
| 0.10-0 |
| 4 |
故答案为:0.025 mol/(L?min);
(2)该反应是可逆反应,所以反应物不能完全转化为生成物,所以氨气的浓度不可能为0.20mol/L;Q>0,所以该反应是放热反应,升高温度,平衡向逆反应方向移动,降低温度,平衡向正反应方向移动,所以氨气的浓度不可能为0.10mol/L,故选ac,
故答案为:a、c;
(3)化学平衡常数K=
| c2(NH3) |
| c(N2)c3(H2) |
故答案为;
| c2(NH3) |
| c(N2)c3(H2) |
(4)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L.
故答案为:
 ;
;(5)在AlCl3 溶液中通入NH3,应产生白色沉淀Al(OH)3.Ksp[Al(OH)3]=c(Al3+)×[c(OH-)]3代入数据,可得c(OH-)=1.0×10-10mol/L,常温下,pH=4,
故答案为:产生百色沉淀;4.
点评:本题考查了化学反应速率的定量表示方法、化学平衡常数、化学平衡的影响因素等知识点,同一化学反应中化学平衡常数只与温度有关,与反应物、生成物的浓度无关.

练习册系列答案
相关题目
 一定温度下,向一2L的恒容密闭容器内加入0.2molN2和0.6mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:
一定温度下,向一2L的恒容密闭容器内加入0.2molN2和0.6mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示: 2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。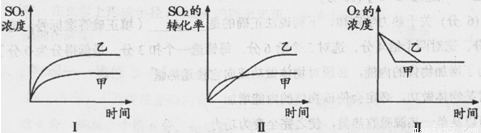
 2NH3(g) △H<0。反应中NH3的物质的量浓度的变化的情况如下图所示:
2NH3(g) △H<0。反应中NH3的物质的量浓度的变化的情况如下图所示: 