题目内容
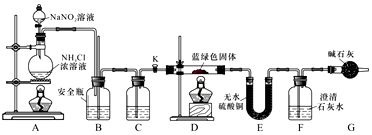
8.亚硝酰氯(NOC1)的沸点为-5.5℃,具有刺鼻恶臭味,在潮湿空气中易水解,溶于浓硫酸,是而机合成中的重要试剂.某同学用如图装置,由NO与干燥纯净的Cl2反应制备NOCl.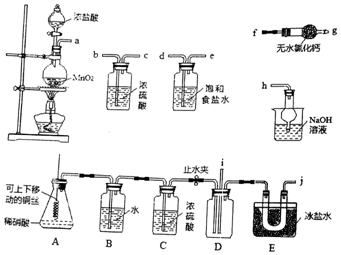
己知:
①Cl2沸点为-34.6℃,NO2Cl沸点为-15℃
?2NO+Cl2═2NOC1 2NO2+Cl2=2NO2C1
回答下列问题:
(1)铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;装置A中设计了可上下移动的铜丝,其优点是可控制反应的开始和停止.
(2)图中实验装置的连接顺序为:a→d、e-b、c-i、j-f、g-h.
(3)实验时,先制取氯气使充满除A、B、C外的整套装置,目的是排出装置中的空气;装置中充满氯气后,下-步是制取NO,具体操作是打开止水夹,并将铜丝插入稀硝酸中;E中冰盐水的温度可低至-22℃,其作用是将NOCl冷凝为液态.
(4)该同学的实验设计可能的不足之处是B、C上部的空气会将NO氧化(答出一条即可).
(5)若无C装置,则不利于NOCl的制备,主要原因是NOCl+H2O=HNO2+HCl(用化学方程式表示).
分析 由氯气与一氧化氮在常温常压下合成:由二氧化锰与浓盐酸制备氯气,制得的氯气中混有氯化氢和水蒸气,用饱和食盐水吸收氯化氢气体,用浓硫酸干燥,由A制备NO,用铜和稀硝酸反应制备,制得的NO中可能混有其他氮氧化合物,故B用水净化NO,装置C用浓硫酸干燥,将氯气和NO干燥后在装置D中发生反应,在冰盐E中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置,据此分析解答.
解答 解:(1)铜与稀硝酸制备NO,化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,装置A中设计了可上下移动的铜丝,可控制反应的开始和停止;
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;可控制反应的开始和停止;
(2)由二氧化锰与浓盐酸制备氯气,制得的氯气中混有氯化氢和水蒸气,用饱和食盐水吸收氯化氢气体,用浓硫酸干燥,则a连接d、e-b、c,将干燥后的氯气和NO在装置D中发生反应,在冰盐E中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置,故i、j-f、g-h;
故答案为:d、e-b、c-i、j-f、g-h;
(3)为排出装置中的空气,实验时,先制取氯气使充满除A、B、C外的整套装置,装置中充满氯气后,打开止水夹,并将铜丝插入稀硝酸中,制备NO,E中冰盐水将NOCl冷凝为液态,便于收集;
故答案为:排出装置中的空气;打开止水夹,并将铜丝插入稀硝酸中;将NOCl冷凝为液态;
(4)NO遇空气被氧化,B、C上部的空气会将NO氧化,不利于反应;
故答案为:B、C上部的空气会将NO氧化;
(5)若无C装置,NOCl与水蒸气发生反应:NOCl+H2O=HNO2+HCl;
故答案为:NOCl+H2O=HNO2+HCl.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,2.24LCCL4含有0.1NA个CCL4 | |
| B. | 7.8gNa2O2中所含阴离子的数目是0.1NA | |
| C. | 含NA个Na的Na2O溶解于1L水中,Na的物质的量浓度为1mol/L | |
| D. | 常温下,1LpH=1的CH4COOH溶液加水稀释后H+数目为0.1NA |
| A. | Na2O2可用作供氧剂 | |
| B. | Al2O3可用作耐火材料 | |
| C. | 地沟油经处理后可用作燃料油 | |
| D. | 胶体和溶液的本质区别是胶体具有丁达尔现象 |
| A. | 洗净的容量瓶可以放进烘箱中烘干 | |
| B. | 用磨口玻璃瓶保存NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗的下口放出 | |
| D. | 用二硫化碳清洗残留在试管壁上少量的硫粉 |
| A. | Na在空气中久置最终变为NaHCO3粉末 | |
| B. | 向Fe2(SO4)3溶液中加入铜粉,溶液变蓝且有黑色固体析出 | |
| C. | C12能与石灰乳反应,可用于制取漂白粉 | |
| D. | 向KC1O3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
| A. | “你我的消化系统是化学过程的场所”:在胃中,pH<7有利于消化 | |
| B. | “你我要飞天探地 化学提供动力几何”:人们可以研究新催化剂,将水分解并提供能量 | |
| C. | “记忆和思维活动 要借化学过程来描摹”:记忆与思维过程伴随着化学变化 | |
| D. | “即便你我的喜怒哀乐 也是化学神出鬼没”:情绪变化不会产生新的原子 |
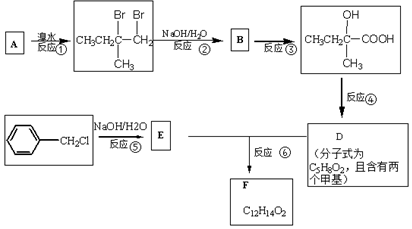
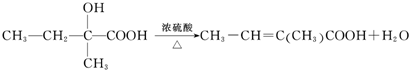 .
.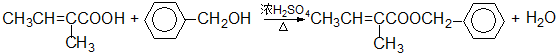 .
. .
.