题目内容
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示。则下列选项正确的是
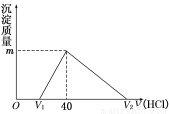
A.原合金质量为0.92 g B.标准状况下产生氢气896 mL
C.图中V2为60 mL D.图中m值为1.56 g
D
【解析】
试题分析:将一定量的钠铝合金置于水中,合金全部溶解,得到20mLpH=14的溶液,溶液呈碱性,故溶液中溶质为氢氧化钠、偏铝酸钠,n(NaOH)(过量)=0.02L×1mol/L=0.02mol,由于发生反应:HCl+NaOH=NaCl+ H2O;所以消耗盐酸的物质的量也是0.02mol,因此其体积是V(HCl)=0.02mol÷1 mol/L=0.02L=20ml,所以V1为20ml。因此与偏铝酸钠反应的盐酸是20ml,由方程式可知NaAlO2+H2O+HCl= Al(OH)3↓+ NaCl;生成氢氧化铝是0.02mol,质量是1.56g,D正确。根据原子守恒可知金属铝的质量是0.02mol×27g/mol=0.54g。向溶液中加入lmol?L-1的盐酸滴定,至沉淀质量最大时,此时溶液中溶质为氯化钠,根据溶液中电荷守恒可知n(Na+)=n(Cl-)=0.04mol×1mol/L=0.04mol,则金属钠的质量是0.92g,则原合金的质量是0.92g+0.54g=1.46g,选项A错误;由方程式2Na+2H2O=2NaOH+H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知生成氢气是0.02mol+0.03mol=0.05mol,标准状况下的体积是1.12,所以选项B不正确;当沉淀恰好完全溶解时溶液为NaCl、AlCl3的混合溶液,根据元素守恒可得n(HCl)=n(Na)+3n(Al)= 0.04mol +0.02mol×3=0.1mol,v(HCl)=n÷V=0.1mol÷1mol/L=0.1L=100ml,所以V2=100ml,所以选项C错误。正确选项是D。
考点:考查图像法在Na、Al混合物的有关计算的知识。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中R与T原子序数之和为20,下列判断正确的是
|
| R |
| |
T | Q |
| W | G |
A.离子半径:T> W
B.最高价氧化物对应水化物的酸性:Q >W>G
C.最简单气态氢化物的热稳定性:Q < R
D.T和G组成的化合物甲溶于水,其水溶液呈中性


