题目内容
14.配制pH=11的氢氧化钠溶液10L,需Na0H固体质量,m(Na0H)=0.4g.分析 pH=11的氢氧化钠溶液中,c(H+)=10-11mol/L,则c(OH-)=$\frac{Kw}{c({H}^{+})}$,而c(NaOH)=c(OH-),故可以求出n(NaOH)=nV,从而求出m(NaOH),据此分析.
解答 解:pH=11的氢氧化钠溶液中,c(H+)=10-11mol/L,则c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,而c(NaOH)=c(OH-),故10L溶液中n(NaOH)=nV=10L×10-3mol/L=0.01mol,故m(NaOH)=0.01mol×40g/mol=0.4g,故答案为:0.4g.
点评 本题考查了配制一定pH溶液所需溶质的质量的求算,难度不大,解题关键在于公式的灵活运用.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
4.下列物质属于共价化合物的是( )
| A. | MgCl2 | B. | (NH4)2SO4 | C. | C60 | D. | CO2 |
5.下列有机化合物属于链烃的是( )
| A. |  | B. |  | C. |  | D. |  |
2.可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6一一区分开的试剂是( )
| A. | HCl溶液 | B. | 溴水 | C. | 酸性KMnO4溶液 | D. | NaOH溶液 |
9.果糖的结构简式为CH2OH(CHOH)3COCH2OH,果糖中所含的手性碳原子数为( )
| A. | 0个 | B. | 2个 | C. | 3个 | D. | 4个 |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1molFeCl3水解生成的Fe(OH)3胶粒数为NA | |
| B. | 密闭容器中,28gN2和6gH2充分反应,产物的分子数为2NA | |
| C. | 标准状况下,22.4LCO2与足量Na2O2反应转移的电子数为NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量Cu共热,生成SO2的分子数为0.46NA |
6.下列对化学反应速率和反应限度的叙述正确的是( )
| A. | 决定化学反应速率的主要因素是光照、超声波、压强和催化剂等 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| C. | 可逆反应进行到一定程度时,正、逆反应速率相等.各物质浓度也相等 | |
| D. | 生产过程中,化学反应限度是决定原料利用率和产品产率的重要因素之一 |
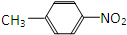 和
和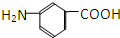 E.35Cl和37Cl
E.35Cl和37Cl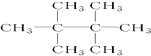 ,
,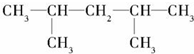 ,该烯烃可能的结构简式有2种.
,该烯烃可能的结构简式有2种. ;燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;其燃烧含碳产物的结构式为:O=C=O;CH4与Cl2生成CCl4的化学方程式CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl.
;燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;其燃烧含碳产物的结构式为:O=C=O;CH4与Cl2生成CCl4的化学方程式CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl.