题目内容
2. 实验室可用氯酸钾与密度为1.19g•cm-3,溶质质量分数为36.5%的浓盐酸反应制取氯气.
实验室可用氯酸钾与密度为1.19g•cm-3,溶质质量分数为36.5%的浓盐酸反应制取氯气.I.反应方程式如下:1KClO3+6HCl=1KCl+3Cl2↑+3H2O
(1)配平方程式,并用双线桥法表示上述反应中电子转移的方向和数目.
(2)若反应中被氧化的盐酸为5mol,则生成的氯气体积为67.2L(标准状况下).
II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
(1)证明氯气和水反应的实验现象为装置B中的有色布条不褪色,装置C中的有色布条褪色,反应的化学方程式是Cl2+H2O?HCl+HClO.
(2)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是CO2+Ca(ClO)2+H2O=CaCO3+2HClO、2HClO═2HCl+O2↑.
III.乙同学用上述浓盐酸配置0.100mol•L-1的稀盐酸480mL,下列说法正确的是B、C.
A.取用240mL的容量瓶
B.应量取上述浓盐酸的体积为4.2mL
C.定容摇匀后发现液面低于刻度线,再加蒸馏水与刻度线相切,所配溶液浓度偏小
D.定容时,仰视刻度线所配溶液浓度偏大
E.量取上述浓盐酸的体积时俯视刻度线所配溶液浓度偏大.
分析 I.(1)反应中KClO3为氧化剂,HCl为还原剂,KClO3中Cl从+5→0,降低5价,HCl中Cl从-1→0价,升高1价,根据化合价升降守恒配平方程式;
(2)根据被氧化的盐酸和生成氯气的关系,5HCl~3Cl2↑进行解答;
II.(1)Cl2与水发生反应,生成HCl和HClO,HClO具有漂白性,但干燥的HClO不能使B中的有色布条褪色,溶于C中的水,能使C中的有色布条褪色,据此解答;
(2)若将氯气通入石灰乳制取漂白粉,发生歧化反应,生成CaCl2和Ca(ClO)2;漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应产生了CaCO3和HClO,HClO不稳定,易分解出HCl和O2,据此写出方程式;
III.A.容量瓶容积不能小于480mL;
B.根据稀释定律,计算所需浓盐酸的量;
C.定容摇匀后发现液面低于刻度线,此时滴加蒸馏水至刻度线,会稀释溶液;
D.定容时仰视刻度线,水加入超过刻度线,溶液浓度减小;
E.量取上述浓盐酸的体积时俯视刻度线,取得量会偏小,导致配制浓度偏小.
解答 解:I.(1)反应中KClO3为氧化剂,HCl为还原剂,KClO3中Cl从+5→0,降低5价,HCl中Cl从-1→0价,升高1价,氧化还原反应中遵循化合价升降守恒,则反应的方程式应为:KClO3+6HCl=HCl+3Cl2↑+3H2O,双线桥法表示电子转移,即 ,
,
故答案为:1;6;1;3;3; ;
;
(2)设则生成的氯气体积为xL,由题意可知:KClO3中Cl元素由+5价变为+0价,HCl中Cl元素由-1价变为0价,由方程式可知当有6molHCl参加反应时,有5mol被氧化;被氧化的盐酸与氯气的关系:5HCl~3Cl2↑,则产生氯气的物质的量为3mol,标况下体积为V=3mol×22.4L/mol=67.2L,
故答案为:67.2L;
II.(1)Cl2与水发生反应,生成HCl和HClO,HClO具有漂白性,但干燥的HClO不能使B中的有色布条褪色,溶于C中的水,能使C中的有色布条褪色,则证明氯气和水反应的实验现象为装置B中的有色布条不褪色,装置C中的有色布条褪色,反应的方程式为:Cl2+H2O?HCl+HClO
故答案为:装置B中的有色布条不褪色,装置C中的有色布条褪色;Cl2+H2O?HCl+HClO;
(2)若将氯气通入石灰乳制取漂白粉,发生歧化反应,生成CaCl2和Ca(ClO)2,反应的方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应产生了CaCO3和HClO,HClO不稳定,易分解出HCl和O2,反应的方程式为CO2+Ca(ClO)2+H2O=CaCO3+2HClO、2HClO═2HCl+O2↑,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;CO2+Ca(ClO)2+H2O=CaCO3+2HClO、2HClO═2HCl+O2↑;
III.A.配置480mL的稀盐酸,容量瓶的规格不应用240mL的,故A错误;
B.根据稀释定律,稀释前后HCl的物质的量保持不变,c1V1=c2V2,应量取稀释前的浓盐酸的体积为V1=$\frac{{c}_{2}{V}_{2}}{{c}_{1}}$=$\frac{0.100×480}{{c}_{2}}$,浓盐酸的密度为1.19g/cm3,溶质质量分数为36.5%,则该浓盐酸的浓度为${c}_{1}=\frac{1000ρ}{M}•ω$=11.9mol/L,则量取的浓盐酸的体积为${V}_{1}=\frac{0.100×480}{11.9}$=4.0mL,考虑到浓盐酸有挥发性,适当量取4.2mL可以减小误差,故B正确;
C.定容摇匀后发现液面低于刻度线,此时滴加蒸馏水至刻度线,会稀释溶液,使所配溶液浓度偏小,故C正确;
D.定容时仰视刻度线,水加入超过刻度线,溶液浓度减小,故D错误;
E.量取上述浓盐酸的体积时俯视刻度线,取得量会偏小,导致配制浓度偏小,故E错误.
故选BC.
点评 本题考查氯气的制备实验,题目综合性较强,侧重分析能力及实验能力及所学知识分析问题、解决问题的能力的综合考查,注意氯气的漂白性的探究实验原理,题目难度中等.注意发生的氧化还原反应及电子守恒、原子守恒的应用.题目难度中等,是中档题.

| A. | 向生石灰中滴加浓氨水以制备纯净的氨气 | |
| B. | 用分液漏斗分离碘和四氯化碳 | |
| C. | 用排饱和硝酸钾溶液法收集铜与浓硝酸反应产生的NO | |
| D. | 向含Al3+的氯化镁溶液中加入过量MgO,过滤得到MgCl2溶液 |
| A. | 电解时在电解池的阳极上不一定有阴离子放电 | |
| B. | 原电池跟电解池连接后,电子从原电池负极流向电解池阳极 | |
| C. | 电解池是将电能转化为化学能的装置 | |
| D. | 电解时,电源负极流出的电子数等于流入电源正极的电子数 |
| A. | 天然油脂是混和物 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 油脂在碱性溶液中能发生皂化反应 | |
| D. | 人造脂肪是液态的油催化加氢形成的 |

查阅资料得下表相关数据:
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 800 |
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(3)为尽量除去杂质,步骤③调节pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯B.铁三脚C.坩埚D.蒸发皿E.泥三角F.烧杯G.石棉网
(5)向装有少量Mg(OH)2浊液的试管中加入适量CH3COONH4晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),CH3COONH4电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
| A. | 铁在硫蒸气中燃烧 | B. | SO2通入石灰水 | ||
| C. | 氯气通入KI溶液 | D. | H2SO4中加入铁粉 |
 .
.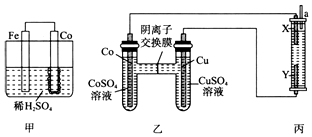 钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处.试回答下列问题:
钴、镍与铁是同族元素,主要化合价均为+2、+3价,它们的单质及化合物的性质有很多相似之处.试回答下列问题: