题目内容
【题目】研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
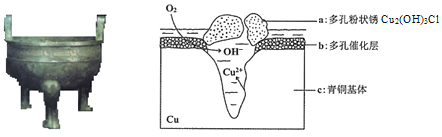
A.青铜器发生吸氧腐蚀,图中c作负极,被氧化
B.正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C.若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
D.环境中的Cl-与电极产物生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl
【答案】C
【解析】
A. 根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极被氧化,腐蚀过程中,负极是c,故A正确;
B. 氧气在正极得电子生成氢氧根离子,电极反应式为:O2+4e+2H2O=4OH,故B正确;
C. 根据转移电子可得n(O2)=![]() =0.2mol,未指明标准状况,无法计算体积,故C 错误;
=0.2mol,未指明标准状况,无法计算体积,故C 错误;
D. Cl扩散到孔口,并与正极反应产物和负极反应产物作用,生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl,离子方程式为2Cu2++3OH+Cl=Cu2(OH)3Cl,故D正确;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g) ![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A.该反应正反应为放热反应
B.容器Ⅰ中前5 min的平均反应速率υ(CO)=0.16 mol·L-1·min-1
C.容器Ⅱ中,a=0.55 mol
D.若容器Ⅰ为恒压,达到平衡时CO转化率小于80%