题目内容
3.下列关于元素周期表的说法正确的是( )| A. | 元素周期表第5列是第Ⅴ副族 | |
| B. | 元素周期表中所含元素种类最多的族是第Ⅷ族 | |
| C. | 第ⅠA族的元素就是碱金属元素 | |
| D. | 元素周期表中第4、5、6、7周期为长周期 |
分析 A.元素周期表第5列是第ⅤB族;
B.元素周期表中所含元素种类最多的族是ⅢB族;
C.第ⅠA族除H以外的元素是碱金属元素;
D.周期表中前三周期为短周期,其它为长周期.
解答 解:A.元素周期表第5列是第ⅤB族,不能表示为第Ⅴ副族,故A错误;
B.元素周期表中所含元素种类最多的族是ⅢB族,含有锕系元素、镧系元素,故B错误;
C.第ⅠA族除H以外的元素是碱金属元素,故C错误;
D.周期表中前三周期为短周期,其它为长周期,故D正确.
故选D.
点评 本题考查长式元素周期表的结构,要求学生对元素周期表的组成特点要熟悉,周期表中周期与周期之间,族与族之间含有较多规律,在学习中要善于抓住这些规律会起到事半功倍的效果.

练习册系列答案
相关题目
13.重铬酸钾(K2Cr2O7)是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备.铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等.
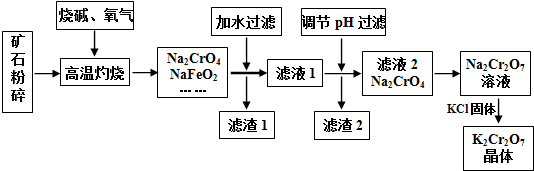
已知:①NaFeO2遇水强烈水解.②2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O请回答下列问题:
(1)将矿石粉碎的目的是增大反应物的表面积,加快反应速率;高温灼烧时Cr2O3发生反应的化学方程式为2Cr2O3+3O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4H2O.
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式FeO2-+2H2O=Fe(OH)3↓+OH-.滤渣2的主要成分是Al(OH)3和H2SiO3.
(3)用简要的文字说明Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小.
(4)25℃时,对反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
①反应达到平衡时,溶液的pH=1,该反应平衡常数K为9.5×104.
②下列有关说法正确的bd.
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2:1时该反应已达平衡状态
d.反应达到平衡时CrO42-的转化率为95%

已知:①NaFeO2遇水强烈水解.②2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O请回答下列问题:
(1)将矿石粉碎的目的是增大反应物的表面积,加快反应速率;高温灼烧时Cr2O3发生反应的化学方程式为2Cr2O3+3O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4H2O.
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式FeO2-+2H2O=Fe(OH)3↓+OH-.滤渣2的主要成分是Al(OH)3和H2SiO3.
(3)用简要的文字说明Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小.
(4)25℃时,对反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
②下列有关说法正确的bd.
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2:1时该反应已达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
14.下列关于硅元素及其化合物的有关说法不正确的是( )
| A. | SiO2是水晶、玛瑙的主要成分,也是制造光导纤维的原料 | |
| B. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 | |
| C. | 盛放NaOH溶液的试剂用橡皮塞,而不用玻璃塞 | |
| D. | Si是良好的半导体材料,是将太阳能转换为电能的常用材料 |
11.下列热方程式书写正确的是( )
| A. | 2SO2+O2=2SO3△H=-196.6 kJ/mol | B. | 2H2(g)+O2(g)=2H2O(l)△H=-517.6 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ | D. | C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol |
15.关于石油炼制的说法正确的是( )
| A. | 石油经分馏得到的各馏分仍然是多种烃的混合物 | |
| B. | 石油分馏的目的是将含碳原子数较多的烃先气化,经冷凝而分离出来 | |
| C. | 石油经过分馏、裂化等工序后得到大量乙烯、苯等不饱和烃 | |
| D. | 石油的炼制过程是将相对分子质量较大分子变成相对分子质量较小分子的过程 |
13.把14.8g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2mol•L-1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
| A. | 3.18g | B. | 6.36g | C. | 4.22g | D. | 5.28g |




