题目内容
18.N原子的摩尔质量是14g/mol,1.5mol HNO3约含有4.5NA个氧原子.含0.6mol H 的C6H12O6的物质的量是0.05mol.分析 N原子的摩尔质量以g/mol为单位时与其相对原子质量在数值上相等;根据N=nNA计算出含有氧原子数;结合分子式C6H12O6计算出含0.6mol H时的物质的量.
解答 解:原子的摩尔质量为:M(N)=14g/mol;1.5molHNO3约含有4.5molO原子,N(O)=4.5NA,含0.6molH的C6H12O6的物质的量是:$\frac{0.6mol}{12}$=0.05mol,
故答案为:14g/mol;4.5NA;0.05.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用以及物质的构成,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
6.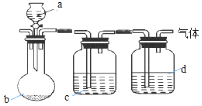 用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
 用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )| 气体 | a | b | c | d | |
| A | CO2 | 稀硫酸 | 石灰石 | 饱和Na2CO3溶液 | 浓H2SO4 |
| B | Cl2 | 浓盐酸 | KMnO4固体 | 饱和NaCl溶液 | 浓H2SO4 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 碱石灰 |
| D | H2 | 硝酸 | 锌粒 | H2O | P2O5 |
| A. | A | B. | B | C. | C | D. | D |
6.仅利用所提供实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、蒸发皿 | 氯化钠溶液的蒸发结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去二氧化硅中的少量碳酸钙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体硫酸钠配制0.1 mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
13.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1 mol?L-1甲酸溶液的c(H+)约为1×10-2mol?L-1 | |
| B. | 甲酸能与活泼金属反应生成氢气 | |
| C. | 10 mL 1 mol?L-1甲酸恰好与10 mL 1 mol?L-1 NaOH溶液完全反应 | |
| D. | 在相同条件下,甲酸溶液的导电性比二元强酸溶液的弱 |
10.在反应KClO3+5KCl+3H2SO4=3Cl2↑+3K2SO4+3H2O中,被氧化和被还原的氯原子个数比为( )
| A. | 1:6 | B. | 6:1 | C. | 1:5 | D. | 5:1 |
7.实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg=Cu2HgI4+2Cu.下列有关说法正确的是( )
| A. | 上述反应的产物Cu2HgI4中,Hg的化合价为+2 | |
| B. | 上述反应中CuI既是氧化剂,又是还原剂 | |
| C. | 上述反应中Hg与Cu均发生氧化反应 | |
| D. | 上述反应中生成64gCu时,转移的电子数为6.02×1023 |
 秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中:
秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,其中: