题目内容
26
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式 ;
已知:3Fe (s)+2O2(g)== Fe3O4(s) △H=-1118.4kJ?? mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H= ,该反应达平衡时,化学平衡常数表达式K= 。
(2)某学生实验小组用50mL0.50mol??L—1的盐酸与50mL0.50mol??L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定![]()
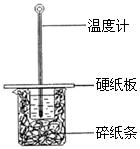
①图中装置缺少的一种仪器,该仪器名称为 。
②将反应混合液的 温度记为反应的终止温度。
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
练习册系列答案
相关题目
在一定温度下的密闭容器中存在如下反应2SO2(g)+O2(g) 2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )
2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )
| A.0.24 mol·L-1 | B.0.28 mol·L-1 |
| C.0.32 mol·L-1 | D.0.26 mol·L-1 |


 2SO3(g),已知c(SO2)始=0.4
mol·L-1,c(O2)始=1
mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )
2SO3(g),已知c(SO2)始=0.4
mol·L-1,c(O2)始=1
mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )