题目内容
14.有A、B、C三种元素,已知①4g A元素的单质与水作用,在标准状况下放出氢气2.24L;②B元素可与A元素形成AB2型的离子化合物,且知A、B的离子具有相同的核外电子排布;③元素C的气态氢化物可以与其最高价氧化物对应的水化物发生非氧化还原反应生成盐,1mol该盐含有42mol电子.根据以上信息填写下列空白:(1)元素符号A:Ca,B:Cl,C:N.
(2)A元素的离子结构示意图为
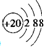 .
.(3)用电子式表示AB2的形成过程
 .
.(4)C的气态氢化物与B的气态氢化物反应时生成物的化学式为NH4Cl,该物质中存在的化学键有离子键、共价键.
分析 有A、B、C三种元素,①4g A元素的单质与水作用,在标准状况下放出氢气2.24L,转移电子为$\frac{2.24L}{22.4L/mol}$×2=0.2mol,A为金属元素,令其摩尔质量为ag/mol、化合价为n,则$\frac{4}{a}$×n=0.2,故n=2、a=40符合题意,可知A为Ca;②B元素可与A元素形成AB2型的离子化合物,B表现-1价,且A、B的离子具有相同的核外电子排布,则B为Cl;③元素C的气态氢化物可以与其最高价氧化物对应的水化物发生非氧化还原反应生成盐,则C为N元素,1mol该盐含有42mol电子,该盐为NH4NO3.
解答 解:有A、B、C三种元素,①4g A元素的单质与水作用,在标准状况下放出氢气2.24L,转移电子为$\frac{2.24L}{22.4L/mol}$×2=0.2mol,A为金属元素,令其摩尔质量为ag/mol、化合价为n,则$\frac{4}{a}$×n=0.2,故n=2、a=40符合题意,可知A为Ca;②B元素可与A元素形成AB2型的离子化合物,B表现-1价,且A、B的离子具有相同的核外电子排布,则B为Cl;③元素C的气态氢化物可以与其最高价氧化物对应的水化物发生非氧化还原反应生成盐,则C为N元素,1mol该盐含有42mol电子,该盐为NH4NO3.
(1)由上述分析可知,A为Ca,B为Cl,C为N,
故答案为:Ca;Cl;N;
(2)A为Ca元素,Ca2+离子结构示意图为 ,
,
故答案为: ;
;
(3)用电子式表示CaCl2的形成过程为: ,
,
故答案为: ;
;
(4)氨气与HCl反应生成NH4Cl,含有离子键、共价键,
故答案为:NH4Cl;离子键、共价键.
点评 本题考查元素化合物性质与推断、常用化学用语等,关键是计算讨论确定A为Ca元素,注意用电子式表示物质或化学键的形成.

| A. | 碳酸钙中滴入盐酸 CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | Fe(OH)3 中滴入硫酸 OH-+H +═H2O | |
| C. | AgNO3中滴入NaCl溶液 Ag ++Cl-═AgCl↓ | |
| D. | CO2通入到足量NaOH溶液中CO2+2OH-═CO32-+H2O |
| 事实 | 原因 | |
| A | 稀有气体的晶体属于原子晶体 | 其组成微粒是原子 |
| B | 键的极性H-O>H-S | 氧的电负性强于S的电负性 |
| C | HF稳定性比HI强 | HF分子间能形成氢键而HI不能 |
| D | 金刚石的熔沸点高于晶体硅 | C-C键能大于Si-Si键能 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲基的电子式为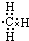 | |
| B. | 大量获得乙烯的工业方法是乙醇的消去反应 | |
| C. | C3H8只能表示一种物质 | |
| D. | 乙烷在光照的条件下与氯气混和,最多可以生成10种物质 |
| A. | 元素族序数一定等于它的最外层电子数 | |
| B. | 同周期元素的电子层数都相同 | |
| C. | 最外层电子数相同的元素都在同一族 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
| A. | 含X与Y的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
| A. | 其水溶液导电的一定是离子晶体 | |
| B. | 固态导电的一定是金属晶体 | |
| C. | 共价化合物形成的晶体一定是分子晶体 | |
| D. | 固态不导电、熔融态导电的一定是离子晶体 |
| A. | 苯、甲苯、溴乙烷(酸性高锰酸钾溶液) | B. | 乙醇、乙醛、乙酸(新制Cu(OH)2 | ||
| C. | 苯、乙醇、四氯化碳(水) | D. | 苯、己烷、苯酚溶液(浓溴水) |
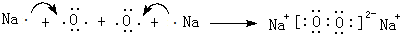 .
.