题目内容
5.以下有关原子结构、元素周期律以及元素周期表的叙述正确的是( )| A. | 第ⅠA族元素从上到下,单质的熔点逐渐降低 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 所有主族元素原子的最外层电子数都等于元素的最高正化合价 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
分析 A.第ⅠA族元素从上到下单质熔点逐渐降低;
B.多电子原子中,离核越近电子能力越低,离核越远电子具有能量越高;
C.O、F元素无正化合价;
D.元素周期表中位于金属和非金属分界线附近的元素属于半导体元素.
解答 解:A.IA元素除氢外,金属单质的熔点随核电荷数的增加而降低,因为单质属于金属晶体,熔沸点与金属键能有关,原子半径越来越大,金属键越来越弱,所以熔沸点逐渐降低,故A错误;
B.多电子原子中,在离核较远的区域内运动的电子能量较高,在离核较近的区域内运动的电子能量较低,故B正确;
C.一般来讲主族元素原子的最外层电子数都等于元素的最高正化合价,但是F、O元素没有没有正价,故C错误;
D.元素周期表中位于金属元素和非金属元素分界线附近的元素具有金属和非金属的性质,可以作半导体材料,如Si,副族元素和第VIII族元素属于过渡元素,故D错误;
故选B.
点评 本题考查较为综合,涉及原子构成、元素周期律、元素周期表等知识点,为高考高频点,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列过程有化学键被破坏同时又有化学键形成的是( )
| A. | 碘升华 | B. | 氯气溶于水 | C. | 氯化钠晶体熔融 | D. | NH4Cl |
10.下列关于反应类型的说法不正确的是( )
| A. | 甲烷和氯气反应属于取代反应 | |
| B. | 乙烯和溴水反应属于取代反应 | |
| C. | 乙醇和酸性高锰酸钾溶液反应属于氧化反应 | |
| D. | 苯燃烧属于氧化反应 |
17.对Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 碱性:NaOH<Mg(OH)2<Al(OH)3 | B. | 价电子数:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 第一电离能:Na<Mg<Al |
14.常温下,电解质溶液中的下列关系式不正确的是( )
| A. | 已知A-+H2B(过量)═HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在0.1 mol?L-1的氨水中滴加0.1 mol?L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol?L-1 | |
| C. | 将c mol?L-1的醋酸溶液与0.02 mol?L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{{2×1{0^{-9}}}}{c-0.02}$ | |
| D. | 将0.2 mol•L-1盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序: c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
15.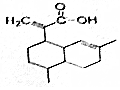 有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
 有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )| A. | X为烃的含氧衍生物 | |
| B. | 1molX最多可以和3mol H2发生加成反应 | |
| C. | X只能发生取代反应和加成反应 | |
| D. | X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 |




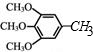 )是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下:
)是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下: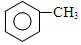 $\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$
$\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$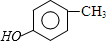 $→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$
$→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$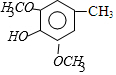 $\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
$\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$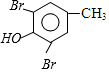 ,C的结构简式为
,C的结构简式为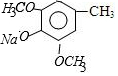 .
.