题目内容
16. T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.
T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g),正反应为放热(填“吸热”或“放热”)反应.
(2)t1 min后,改变下列某一条件,保持其他条件不变,保持容器总体积不变,通入少量稀有气体平衡不移动; 增大压强平衡向正反应方向移动;保持其他条件不变,升高温度平衡向逆反应方向移动.
分析 (1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比判断反应的化学方程式;由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明生成温度平衡向逆反应方向移动,据此判断该反应是吸热还是放热反应;
(2)该反应为放热反应,根据压强、温度、稀有气体对反应A+3B?2C的影响进行判断.
解答 解:(1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,则反应的化学方程式为:A(g)+3B(g)?2C(g);由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明升高温度平衡向逆反应方向移动,正反应为放热反应,
故答案为:A(g)+3B(g)?2C(g);放热;
(2)因为反应为:A(g)+3B(g)?2C(g),保持容器总体积不变,通入少量稀有气体,各组分的浓度不变,平衡不发生移动;保持其他条件不变,增大压强,平衡向正反应方向移动;该反应为放热反应,升高温度平衡向着向逆反应方向移动,
故答案为:不;正;逆.
点评 本题考查化学平衡图象问题,题目难度中等,解答该题时注意分析图象的曲线变化特点,由图象得出反应的化学方程式为解答该题的关键.

练习册系列答案
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
2.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.05molH2O2中含有的阴离子数为0.05NA | |
| C. | 3mol单质Fe与足量水蒸气在一定条件下反应失去9NA 个电子 | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
7.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3).
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(或之间的数据值)(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3).
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2~3.8(或之间的数据值)(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
4.下列离子方程式正确的是( )
| A. | 碳酸氢钠溶液与少量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| D. | 铁跟氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
11.关于吸热反应的说法正确的是( )
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 相同条件下,2molH2(g)与lmolO2(g)完全化合生成2molH2O(g),放出aKJ热量,2molH2 (g)与lmolO2(g)完全化合生成2molH2O(l),放出bkJ 热量,则a>b | |
| C. | 若CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| D. | 相同条件下,1molH2O(l)与1molCaO完全化合,放出a kJ热量,2molH2O(l)与2molCaO完全化合,也放出a kJ热量 |
8.生理盐水是指质量分数为0.9%的NaCl溶液.下列有关该溶液说法正确的是( )
| A. | 100g溶液中含有0.9 g NaCl | B. | 100 g水中含有0.9 g NaCl | ||
| C. | 100 g溶液中含有0.9 mol NaCl | D. | 100 g水中含有0.9 mol NaCl |
5.研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是( )
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氨水 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
6.下列反应过程中的能量变化与如图一致的是( )
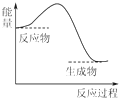

| A. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | D. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO |