题目内容
能正确表示下列反应的离子方程式是( )
A、实验室用MnO2、浓盐酸制备Cl2:MnO2+4H++2Cl-
| ||||
| B、氧化铁可溶于氢碘酸(HI):Fe2O3+6H+═2Fe3++3H2O | ||||
| C、少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | ||||
| D、碳酸氢钙溶液和少量氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.MnO2、浓盐酸在加热条件下反应生成氯化锰、氯气和水;
B.三价铁离子能够氧化碘离子;
C.电荷不守恒;
D.碳酸氢钙与少量氢氧化钠反应生成碳酸钙和碳酸氢钠.
B.三价铁离子能够氧化碘离子;
C.电荷不守恒;
D.碳酸氢钙与少量氢氧化钠反应生成碳酸钙和碳酸氢钠.
解答:
解:A.实验室用MnO2、浓盐酸制备Cl2,离子方程式:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑,故A正确;
B.氧化铁可溶于氢碘酸(HI),离子方程式:Fe2O3+2I-+6H+=2Fe2++3H2O+I2,故B错误;
C.少量金属钠放入冷水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.碳酸氢钙溶液和少量氢氧化钠溶液混合,离子方程式:Ca2++HCO3-+OH-═CaCO3↓+H2O,故D错误;
故选:A.
| ||
B.氧化铁可溶于氢碘酸(HI),离子方程式:Fe2O3+2I-+6H+=2Fe2++3H2O+I2,故B错误;
C.少量金属钠放入冷水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.碳酸氢钙溶液和少量氢氧化钠溶液混合,离子方程式:Ca2++HCO3-+OH-═CaCO3↓+H2O,故D错误;
故选:A.
点评:本题考查了离子方程式的正误判断,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,注意离子方程式应遵循电荷守恒、原子个数守恒.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
分子为C10H14的分子中含有苯环,且苯环上只有一个取代基,其可能的结构有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列实验操作中不正确的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、过滤时,若过滤速度太慢,可以拿玻璃棒搅拌漏斗中固体,加快过滤速度 |
| D、焰色反应实验时,可以用洁净的铁丝直接蘸取所测试剂的固体粉末,置于煤气灯火焰上灼烧 |
下列有关化学用语正确的是( )
A、甲烷分子的球棍模型 |
B、NH4I的电子式 |
C、F的原子结构示意图 |
D、苯酚的电离方程式: +H2O? +H2O? +H3O+ +H3O+ |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、标准状况下2.24L氯气通入水中,电子转移数为0.1NA |
| B、6.8g熔融的KHSO4中含有0.1Na个阳离子 |
| C、CO和N2为等电子体,22.4L的CO气体与NA 个N2所含的电子数相等 |
| D、0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA |
汶川“5?12”大地震震惊全球,一些化工厂受地震影响相继发生过氨气泄漏事故和重大液氯泄漏事故,幸好部队抢险及时,避免了人民生命财产的损失.下列有关氯气和氨气的说法正确的是( )
| A、氯气和氨气都是由极性键构成的分子 |
| B、氯气和氨气都是无色、密度比空气大的有毒气体 |
| C、氯气和氨气都是易液化的气体 |
| D、氯气和氨气分子中所有原子都满足最外层为8电子结构 |
用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的是( )
A、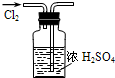 干燥Cl2 |
B、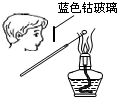 检验K2CO3中的K+ |
C、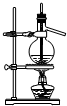 石油的蒸馏 |
D、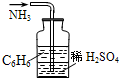 吸收NH3 |



