题目内容
11.在下列变化过程中,只发生物理变化的是( )| A. | 荔枝酿酒 | B. | 酸雨侵蚀建筑物 | ||
| C. | 空气液化制取氮气 | D. | 生石灰遇水成为碱石灰 |
分析 A.荔枝酿酒的过程包括物质氧化的过程;
B.酸雨侵蚀建筑物是建筑物和酸反应的过程;
C.空气液化制取氮气的原理是根据氮气和氧气沸点的不同来实现物质分离的方法;
D.生石灰遇水发生反应生成氢氧化钙,即熟石灰.
解答 A.荔枝酿酒的过程包括物质氧化的过程,有化学变化,故A错误;
B.酸雨侵蚀建筑物是建筑物和酸反应的过程,有新物质生成,故B错误;
C.空气液化制取氮气的原理是根据氮气和氧气沸点的不同来实现物质分离的方法,没有新物质生成,属于物理变化过程,故C正确;
D.生石灰遇水发生反应生成氢氧化钙,即熟石灰,有新物质生成,属于化学变化,故D错误.
故选C.
点评 本考点考查了物理变化和化学变化的区别,难度不大,只要抓住关键点:是否有新物质生成,问题就很容易解决,本考点基础性比较强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
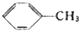 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$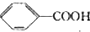
(一)制备苯甲酸
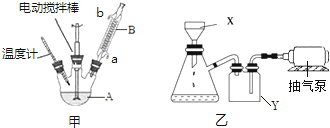
如甲图所示组装反应装置(部分装置未画出),向A中依次加入100mL水、8.5g高锰酸钾、2.7mL甲苯.相关数据如下表:
(1)装置B的作用是冷凝回流,A装置常见的规格有50mL、100mL、250mL、500mL、1000mL,最适合本实验选择的规格是250mL.
(二)分离提纯
停止加热后,按如下流程分离出苯甲酸和回收未反应的甲苯:
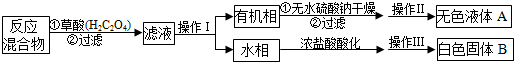
(2)操作I的名称是分液,操作Ⅱ时,应将有机相盛放在蒸馏烧瓶(填仪器名称)中.
(3)操作Ⅲ包括蒸发浓缩、冷却结晶、抽滤.抽滤装置为上图中的乙装置,将物质放在X装置(布氏漏斗)中,打开抽气泵,一段时间后X装置中剩余的是白色固体B,抽滤装置可以加快过滤速率,其工作原理是抽出装置中的空气,形成压强差,使过滤加快.
(三)提纯和纯度的测定
(4)为了进一步提纯苯甲酸,最好采用的方法是B(填编号).
A.溶于水后再过滤 B.加热升华 C.用乙醇洗涤 D.用甲苯萃取后再分液
(5)称取1.00g样品,加0.50mol/L的NaOH溶液,恰好完全反应时,消耗NaOH 溶液的体积为16.00mL,则产品的纯度为97.6%.
(四)性质验证
(6)设计实验证明苯甲酸是一种比碳酸酸性强的弱酸,简要说明实验操作,现象 和结论.
供选择的试剂:苯甲酸、苯甲酸钾溶液、饱和碳酸钠溶液、氢氧化钠溶液、稀盐酸、酚酞试液、石蕊试液.
 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$
(一)制备苯甲酸

如甲图所示组装反应装置(部分装置未画出),向A中依次加入100mL水、8.5g高锰酸钾、2.7mL甲苯.相关数据如下表:
| 名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | 无色液体、易燃、易挥发 | -95 | 110.6 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 112.4(100℃升华) | 248 | 微溶 | 易溶 |
(二)分离提纯
停止加热后,按如下流程分离出苯甲酸和回收未反应的甲苯:

(2)操作I的名称是分液,操作Ⅱ时,应将有机相盛放在蒸馏烧瓶(填仪器名称)中.
(3)操作Ⅲ包括蒸发浓缩、冷却结晶、抽滤.抽滤装置为上图中的乙装置,将物质放在X装置(布氏漏斗)中,打开抽气泵,一段时间后X装置中剩余的是白色固体B,抽滤装置可以加快过滤速率,其工作原理是抽出装置中的空气,形成压强差,使过滤加快.
(三)提纯和纯度的测定
(4)为了进一步提纯苯甲酸,最好采用的方法是B(填编号).
A.溶于水后再过滤 B.加热升华 C.用乙醇洗涤 D.用甲苯萃取后再分液
(5)称取1.00g样品,加0.50mol/L的NaOH溶液,恰好完全反应时,消耗NaOH 溶液的体积为16.00mL,则产品的纯度为97.6%.
(四)性质验证
(6)设计实验证明苯甲酸是一种比碳酸酸性强的弱酸,简要说明实验操作,现象 和结论.
供选择的试剂:苯甲酸、苯甲酸钾溶液、饱和碳酸钠溶液、氢氧化钠溶液、稀盐酸、酚酞试液、石蕊试液.
2.根据下列反应判断有关物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O═2HI+H2SO4;2FeCl3+2HI═2FeCl2+2HCl+I2.
H2SO3+I2+H2O═2HI+H2SO4;2FeCl3+2HI═2FeCl2+2HCl+I2.
| A. | FeCl2>HI>H2SO3 | B. | HI>FeCl2>H2SO3 | C. | H2SO3>HI>FeCl2 | D. | FeCl2>H2SO3>HI |
6.一定温度下,可逆反应A2(g)+B2(g)?2AB(g)达到平衡状态的标志是( )
| A. | 单位时间内生成 n mol A2,同时生成 n mol AB | |
| B. | 体系内的总压不随时间变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | 单位时间内生成 n mol A2的同时,生成n mol B2 |
16.25℃时,下列有关0.10mol/L Na2SO3溶液的叙述正确的是(忽略溶液体积变化及被空气氧化)( )
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-═CaSO3↓ | |
| B. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 通入HCl至溶液pH=7:c(HSO3-)<c(Cl-) | |
| D. | 加入NaOH固体可使溶液中水的电离程度增大 |
3.用固体氧化物作为电解质的氢氧燃料电池电解Na2S04溶液,已知固体氧化物在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示(c、d均为惰性电极).下列有关说法正确的是( )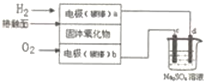

| A. | 电路中电子流向为a→d→c→b | |
| B. | 电极b为负极,电极反应式为O2+4e一=2O2- | |
| C. | 电解后烧杯中溶液pH增大 | |
| D. | 理论上b极消耗气体和c极生成气体质量相等 |
1.下列有关物理量的表达中正确的是( )
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 1mol任何粒子的粒子数叫阿伏加德罗常数 | |
| C. | 若气体摩尔体积为22.4 L•mol-1,则所处条件为标准状况 | |
| D. | 常温下,将4gNaOH溶于100mL水中得到溶质浓度1mol/L的溶液 |
