题目内容
17.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | 将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | ①Na2CO3溶液②CH3COONa溶液③NaOH溶液,若3种溶液pH均为9,则它们物质的量浓度大小顺序是①>②>③ |
分析 A.溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,说明水的电离受到抑制,溶液可能呈酸性或碱性;
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,该溶液中的溶质可能是硫化钠也可能是硫氢化钠,或者是二者的混合物;
C.根据电荷守恒和物料守恒判断离子浓度之间的关系;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-5mol/L.
解答 解:A.某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,说明该溶液能抑制水的电离,可能是酸溶液或碱溶液,所以该溶液的PH值为a或14-a,故A错误;
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,该溶液中的溶质可能是硫化钠也可能是硫氢化钠,或者是二者的混合物,所以不一定存在c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故B错误;
C.将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后,溶液中盐和酸的浓度都是0.05mol/L,根据电荷相等有c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得c(A-)+c(HA)=2c(Na+),所以得2c(OH-)═2c(H+)+c(HA)-c(A-),故C正确;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-5mol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③,故D错误;
故选C.
点评 本题考查离子浓度的大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒等知识为解答关键,试题充分考查学生的分析、理解能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.装置如图2所示
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.装置如图2所示已知:(i)格氏试剂容易水解,
 +H2O→
+H2O→ +M(OH)Br(碱式溴化镁)
+M(OH)Br(碱式溴化镁)(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,溶于乙醇、醚等多数有机溶剂 | |
有固定熔点.
请回答以下问题:
(1)图2中玻璃仪器B的名称:冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)图2中滴加液体未用普通分液漏斗而用恒压滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持微沸,可以采用水浴加热方式.
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:

其中,①操作为:蒸馏或分馏;洗涤液最好选用a(从以下选项中选择);
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已经洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100. 80mL.则产品中三苯甲醇的质量分数为90%.
| A. | 元素化合价升高的反应是还原反应 | |
| B. | 物质在变化中失去了电子,此物质中的某一元素化合价降低 | |
| C. | 有电子转移的反应就是氧化还原反应 | |
| D. | 有化合价升降的反应,不一定是氧化还原反应 |
| A. | IA族与VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1 递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,其在水中越容易水解 | |
| D. | 同周期的主族金属元素的化合价越高,其原子失电子能力越弱 |

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11mol H2反应 | |
| C. | 2,5羟基苯乙酮能发生加成、氧化、还原、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为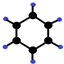 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).A中含官能团名称是碳碳双键.
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
| A. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| B. | 在101kPa时,1molH2完全燃烧生成水蒸汽,放出285.8kJ热量,H2的燃烧热为△H=-285.8kJ•mol-1 | |
| C. | 在101kPa时,1molC与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量等于57.3kJ |