题目内容
4.压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.①CH4(g)+4NO2(g) $\stackrel{催化剂}{?}$4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g)△H3
则△H1,△H2,△H3三者关系正确的是( )
| A. | △H3=(△H1+△H2)/2 | B. | △H3=△H1+△H2 | C. | △H2=△H1+△H3 | D. | △H2=(△H1+△H3)/2 |
分析 压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO2(g)$\stackrel{催化剂}{?}$4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H2
依据盖斯定律$\frac{①+②}{2}$得到目标方程式③,由此分析解答.
解答 解:压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO2(g)$\stackrel{催化剂}{?}$4NO(g)+CO2(g)+2H2O(g)△H1
②CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H2
依据盖斯定律$\frac{①+②}{2}$得到目标方程式③,所以,CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$N2(g)+CO2(g)+2H2O(g)△H3
△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$KJ/mol,
故选:A.
点评 本题考查了盖斯定律计算,学生要学会分析目标反应与已知反应的关系列出关系式就可以迅速解题,题目难度不大.

练习册系列答案
相关题目
12.从下列现象可以判断某一元酸是强酸的是( )
| A. | 加热该酸至沸腾也不分解 | |
| B. | 该酸浓度为0.01 mol•L-1时的pH为2 | |
| C. | 该酸可以把Al(OH)3沉淀溶解 | |
| D. | 该酸可以与石灰石反应放出CO2 |
19.一无色溶液中加入氯化钡溶液,有不溶于稀硝酸的白色沉淀生成,则该溶液中( )
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 一定有Ag+ | D. | 可能有SO42-,也可能有Ag+ |
9.在pH都等于5的HCl和NH4Cl两种溶液中,设由水电离产生的H+离子浓度分别为A mol•L-1与B mol•L-1,则A和B的关系为( )
| A. | A>B | B. | A=10-4B | C. | B=10-4A | D. | A=B |
16.分析如图的能量变化示意图,确定下列选项中正确的是( )


| A. | A2(g)+B2(g)=2AB(g)△H<0 | |
| B. | 每生成2分子AB放出bkJ热量 | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1molA-A键吸收akJ能量 |
13.限用H2SO4、HNO3、CH3COOH、以及NaOH、Ba(OH)2、Cu(OH)2在水溶液中进行反应,符合离子方程式H++OH-=H2O的化学方程式的个数有( )个.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
14.下列反应的离子方程式中,正确 的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铁跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 钠和冷水反应:2Na+2H2O=═2Na++2OH-+H2↑ | |
| D. | FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
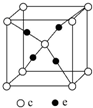 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.