题目内容
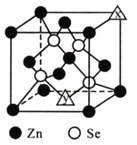
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。

(1)Y在周期表中位于________________;
(2)与钡同族的镁钙锶的碳酸盐受热分解的温度从上至下逐渐_______填“升高”或“降低”),原因是______________________________。
(3)①制备M的化学方程式是__________________________________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____________________m。
【答案】 第四周期第ⅡA族 升高 它们的碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,放出二氧化碳分子的结果,从镁离子到钡离子随着半径逐渐增大,结合氧离子的能力逐渐减弱,所以从上至下碳酸盐受热分解的温度逐渐升高 TiO2+BaCO3(熔融)===BaTiO3+CO2↑ 面心 6 6.15×10-11
【解析】Z的核电荷数小于28,且次外层有2个未成对电子,其价层电子排布应当是![]() ,所以Z为Ti元素,X的一种
,所以Z为Ti元素,X的一种![]() 型氢化物分子中既有
型氢化物分子中既有![]() 键又有
键又有![]() 键,应为
键,应为![]() ,则X为C元素,X、Y和Z三种元素的原子序数之和等于48,则Y的原子序数为20,应为Ca元素;
,则X为C元素,X、Y和Z三种元素的原子序数之和等于48,则Y的原子序数为20,应为Ca元素;
(1)Y为Ca元素,原子序数为20,原子核外有4个电子层,最外层电子数为2,则应位于周期表第四周期、第ⅡA族;正确答案:第四周期、第ⅡA族。
(2)与钡同族的镁、钙、锶的碳酸盐受热分解的温度从上至下逐渐升高,这是因为它们的碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,放出二氧化碳分子的结果,从镁离子到钡离子随着半径逐渐增大,结合氧离子的能力逐渐减弱,所以从上至下碳酸盐受热分解的温度逐渐升高;正确答案:升高; 它们的碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,放出二氧化碳分子的结果,从镁离子到钡离子随着半径逐渐增大,结合氧离子的能力逐渐减弱,所以从上至下碳酸盐受热分解的温度逐渐升高。
(3)①根据题意知M为![]() ,反应的化学方程式为TiO2+BaCO3(熔融)===BaTiO3+CO2↑;正确答案: TiO2+BaCO3(熔融)===BaTiO3+CO2↑。
,反应的化学方程式为TiO2+BaCO3(熔融)===BaTiO3+CO2↑;正确答案: TiO2+BaCO3(熔融)===BaTiO3+CO2↑。
②在![]() 晶体中,若将
晶体中,若将![]() 置于立方体的体心,
置于立方体的体心,![]() 置于立方体的顶点,则
置于立方体的顶点,则![]() 只能处于立方体的面心;正确答案:面心。
只能处于立方体的面心;正确答案:面心。
③由![]() 晶胞可以知道,每个
晶胞可以知道,每个![]() 周围有6个
周围有6个![]() ,所以
,所以![]() 的氧配位数为6;正确答案:6。
的氧配位数为6;正确答案:6。
④设![]() 的半径为r,则有
的半径为r,则有![]() ,则
,则![]() ;正确答案:
;正确答案:![]() 。
。

 名校课堂系列答案
名校课堂系列答案