题目内容
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.(1)乙醇分子中官能团的电子式为
(2)可用
(3)试管a中发生反应的化学方程式为
(4)试管b中盛放的溶液作用是
考点:乙酸乙酯的制取
专题:实验题
分析:(1)乙醇的官能团是羟基;
(2)乙酸乙酯在饱和Na2CO3溶液的上层,故用分液法提取乙酸乙酯,用分液漏斗进行分液操作;
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,为可逆反应;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层.
(2)乙酸乙酯在饱和Na2CO3溶液的上层,故用分液法提取乙酸乙酯,用分液漏斗进行分液操作;
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,为可逆反应;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层.
解答:
解:(1)乙醇的官能团是羟基,电子式为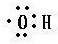 ,故答案为:
,故答案为: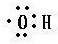 ;
;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,乙酸乙酯在饱和Na2CO3溶液的上层,故用分液法提取乙酸乙酯,用分液漏斗进行分液操作,
故答案为:分液漏斗;
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O;
故答案为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:中和乙酸,溶解乙醇,降低酯在水中的溶解度有利于酯的析出.
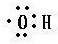 ,故答案为:
,故答案为: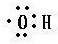 ;
;(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,乙酸乙酯在饱和Na2CO3溶液的上层,故用分液法提取乙酸乙酯,用分液漏斗进行分液操作,
故答案为:分液漏斗;
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水:CH3CH2OH+CH3COOH
| 浓硫酸 |
| △ |
故答案为:CH3CH2OH+CH3COOH
| 浓硫酸 |
| △ |
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:中和乙酸,溶解乙醇,降低酯在水中的溶解度有利于酯的析出.
点评:本题考查了有机物的区分和乙酸乙酯的制备,题目难度不大,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
对于反应3S+6KOH
2K2S+K2SO3+3H2O,下列说法正确的是( )
| ||
| A、S是氧化剂,KOH是还原剂 |
| B、若3mol硫完全反应,则反应中共转移了4mol电子 |
| C、还原剂与氧化剂的质量比是1:2 |
| D、氧化产物和还原产物的物质的量之比为3:2 |
将铁和氧化铁的混合物5.44g加入50mL 3.2mol?L-1的盐酸,恰好完全反应,滴入KSCN溶液后不显红色.若忽略溶液体积的变化,则在所得溶液中Fe2+的浓度约为( )
| A、0.2mol?L-1 |
| B、0.4mol?L-1 |
| C、0.8mol?L-1 |
| D、1.6mol?L-1 |
下列离子组中能大量共存的是( )
| A、Cu2+、NO3-、Fe2+、Cl- |
| B、Fe3+、SO42-、Mg2+、OH- |
| C、Na+、SO32-、NO3-、H+ |
| D、HCO3-、NH4+、H+、Na+ |
下列反应的离子方程式正确的是( )
| A、将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| B、盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ |
| C、铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ |
| D、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
