题目内容
5.下列反应结束后,向其中滴加KSCN溶液,溶液变成血红色的是( )| A. | FeCl2与过量氯气 | B. | FeCl3溶液与过量铜片 | ||
| C. | FeCl3溶液与过量铁粉 | D. | FeSO4溶液与过量Zn粉 |
分析 三价铁离子遇到硫氰酸钾会发生络合反应:Fe3++2SCN-=[Fe(SCN)]2+,[Fe(SCN)]2+显红色;加入适量KSCN溶液后,变成血红色,说明溶液中一定存在铁离子,据此进行解答.
解答 解:A、FeCl2与过量氯气反应生成FeCl3,溶液中存在铁离子,向其中滴加KSCN溶液,溶液变成血红色,故A正确;
B、FeCl3溶液与过量铜片反应生成FeCl2,溶液中不存在铁离子,向其中滴加KSCN溶液,溶液不变血红色,故B错误;
C、FeCl3溶液与过量铁粉反应生成FeCl2,溶液中不存在铁离子,向其中滴加KSCN溶液,溶液不变血红色,故C错误;
D、FeCl2溶液与过量Zn粉生成ZnCl2和Fe,溶液中不存在铁离子,向其中滴加KSCN溶液,溶液不变血红色,故D错误;
故选A.
点评 本题考查了铁离子的检验方法,题目难度不大,试题注重了基础知识的考查,要求熟练掌握铁离子的检验方法;明确检验铁离子常用的试剂:硫氰化钾、苯酚等.

练习册系列答案
相关题目
16.有关化学用语表达错误的是( )
| A. | 乙酸乙酯的结构简式为:CH3COOCH2CH3 | |
| B. | CH4分子的球棍模型 | |
| C. | 甲苯的化学式:C7H8 | |
| D. | 环丙烷的键线式为: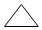 |
13.下列方法不能达到预期目的是( )
| A. | 用溴水鉴别乙烯和CO2 | |
| B. | 用pH试纸鉴别NaCl溶液与Na2CO3溶液 | |
| C. | 用观察外观颜色的方法区别氧化铁和氧化铜 | |
| D. | 用石灰水鉴别CO2和SO2 |
20.下列俗名与物质相匹配的一组是( )
| A. | 水玻璃-Na2SO4 | B. | 石膏-CaSiO3 | C. | 铁红-Fe2O3 | D. | 胆矾-FeSO4 |
10.下列说法错误的是( )
| A. | 糖类、油脂和蛋白质均是高分子化合物 | |
| B. | 雾能产生丁达尔效应,雾属于胶体 | |
| C. | 新制氯水、HClO和SO2都有漂白作用 | |
| D. | 硝酸能与苯发生取代反应 |
17.组成为C6H4S4的物质有吸收微波的功能,可在军事上用做隐形飞机的涂层.下列关于C6H4S4的说法正确的是( )
| A. | 该物质为有机物 | B. | 该物质为无机物 | ||
| C. | 该物质由三种元素组成 | D. | 该物质燃烧产物可能含CO2 |
15.下列指定反应的离子方程式正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| B. | 向FeI2溶液中加入少量氯水:2 Fe2++Cl2═2Fe3++2Cl-(已知:2Fe3++2I-═2 Fe2++I2) | |
| C. | 将过量铁粉投入稀硝酸中:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| D. | 将SO2通入Na2O2粉末中的主要反应为:2Na2O2+2SO2═2 Na2SO3+O2 |
