题目内容
)含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为__________________
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3 min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正 、 V逆)

(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。
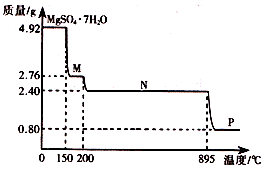
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
(1)① 2SO2(g) + O2(g) = 2 SO3(g) △H = -196.6 kJ/mol
② I.> II.810 L/mol

(2)① MgSO4·H2O ② 2 ③ MgSO4 MgO+SO3↑
MgO+SO3↑
【解析】
试题分析:(1)①写出化学方程式,反应热为 =196.6kJ·mol-1。
=196.6kJ·mol-1。
②I.生成SO3的反应是气体体积减小的反应,恒压条件相当于在恒容条件的基础上再增大压强,因此甲的转化率高,生成的SO3多。
II.根据题意,有 2SO2 + O2 = 2 SO3
初始量/mol: 2 1 0
变化量/mol: 2×90% 1×90% 2×90%
平衡量/mol: 0.2 0.1 1.8
 =810
=810
在该反应条件下,充入1molSO3,与原平衡是等效平衡,充入1molSO2则平衡正向移动,因此作图时注意,平衡正向移动则正反应速率大于逆反应速率,且在原平衡的基础上各物质的浓度都增大。
(2)①4.92g MgSO4·7H2O的物质的量为0.02mol,则M的相对分子质量为 ,因此M的分子式为MgSO4·H2O。
,因此M的分子式为MgSO4·H2O。
②根据①可知,第一阶段失去6个结晶水,还剩余1个,只需要一个阶段,因此共有2个阶段。
③根据题意,M到N失去所有结晶水,N阶段物质为MgSO4,接下来为MgSO4分解,根据题中数据,Mg的物质的量为0.02mol,则P阶段的物质的相对分子质量为0.8g÷0.02mol=40g/mol,即分解产物为MgO,根据原子守恒,另一氧化物为SO3。
考点:考查热化学方程式书写,等效平衡,平衡常数计算,影响化学平衡的因素,化学平衡图像,图像分析,实验数据处理等。