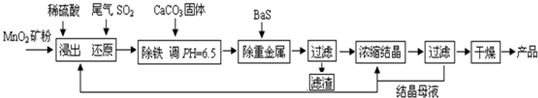
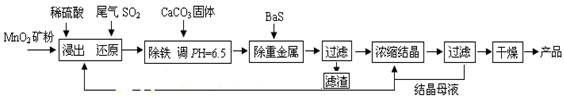
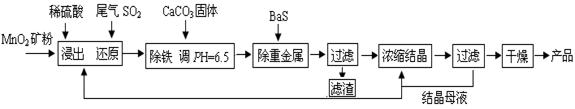
��Ŀ����
MnSO4��H2O�ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�á���ҵ���û�����β���е�Ũ��SO2��ԭMnO2���Ʊ�MnSO4��H2O�������£�
��֪�� ����ʱ�������������ε�Ksp��CuS--6.3��10-36��PbS--1.0��10-28��NiS--2.0��10-26��
MnS--2.5��10-10����ش��������⣺
��1��������MnO2������Ŀ���� ��
��2���������������ӷ�Ӧ����ʽΪ ��
��3�����ؽ������Ӻ��������Һ��Cu2+��Pb2+��Ni2+��Ũ�Ⱦ�Ϊ1.0��10-5mol/L����c(S2-)���= mol/L��
��4����֪MnSO4��H2O��1150������·ֽ�IJ�����Mn3O4�������ˮ�����ڸ������������̾���ֽⷴӦ�Ļ�ѧ����ʽ��
��12�֣���1������Ӧ��Ӵ�������ӿ췴Ӧ���ʣ� ��3�֣�
��2��2Fe3+ + 3H2O + 3CaCO3 �� 2Fe(OH)3��+ 3CO2��+ 3Ca2+ (3��)
���� Fe3+ + 3H2O = Fe(OH)3��+ 3H+ 2H+ + CaCO3 = Ca2+ + CO2��+ H2O ��
��3��6.3��10-31 ��3�֣� ��4��3MnSO4��H2O Mn3O4 + SO2��+ 2SO3��+
3H2O ��3�֣�
Mn3O4 + SO2��+ 2SO3��+
3H2O ��3�֣�
��������
�����������1��������MnO2����������˷�Ӧ��ĽӴ�������ӿ��˻�ѧ��Ӧ���ʣ�����Ϊ������Ӧ��Ӵ�������ӿ췴Ӧ���ʡ�
��2����Һ���ܽ�ȴ���������ܽ��С������ת����̼��Ƶ��ܶȻ����������������ܶȻ���������ˮ��Һ������Ӻ�̼��Ʒ�Ӧ�����������������ӷ���ʽΪ2Fe3+ + 3H2O + 3CaCO3 �� 2Fe(OH)3��+ 3CO2��+ 3Ca2+��
��3������Һ���ܶȻ���С������ǡ�ñ���ʱ�����ӵ�Ũ�Ȳ�����ܶȻ���С����CuS--6.3��10-36������Һ��Cu2+Ϊ1.0��10-5mol/L����c��S2-������� ��6.3��10-31 mol/L��
��6.3��10-31 mol/L��
��4��MnSO4?H2O��1150������·ֽ�IJ�����Mn3O4�������ˮ������Mn3O4��Ԫ��ʧ���ӣ����ɶ��������ǵõ��ӣ�����������ԭ��Ӧ�е�ʧ��������Ƚ��ԭ���غ�ó���Ӧ����ʽΪ
3MnSO4��H2O Mn3O4 + SO2��+ 2SO3��+
3H2O��
Mn3O4 + SO2��+ 2SO3��+
3H2O��
���㣺������Ԫ�ػ���������ʡ����ӷ���ʽ�ͻ�ѧ��Ӧ����ʽ����д����������Է�Ӧ���ʵ�Ӱ��
�������������Ʊ�MnSO4��H2OΪ���壬�ص㿼��ѧ���Թ������������˽���������������ۺ���ǿ�������߿������ض�ѧ��������������ѵ��������������ѧ���������������淶�Ͻ���ʵ����������Լ����ֲ������������������ۺ���ǿ�����ۺ�ʵ������ϵ���ܣ��еĻ��ṩһЩ�µ���Ϣ�����Ҫ��ѧ���������桢ϸ�µ����⣬��ϵ��ѧ����֪ʶ�ͼ��ܣ�����֪ʶ����ȡ�Ǩ�ơ����飬ȫ��ϸ�µ�˼�����ܵó���ȷ�Ľ��ۡ�������״����ǣ�3������ȷ���ܶȻ���С�Ķ�����������ʱ�������ӵ�Ũ�Ȳ������������������ȷ���

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�

 Fe��OH��3+3H+ 2H++CaCO3=Ca2++CO2��+H2O
Fe��OH��3+3H+ 2H++CaCO3=Ca2++CO2��+H2O Mn3O4+SO2��+2SO3��+3H2O
Mn3O4+SO2��+2SO3��+3H2O