题目内容
1molO2与1molCO2相比较,下列叙述中正确的是
- A.在同温同压下,体积相等
- B.在同温同压下,密度相等
- C.在标准状况下,质量相等
- D.所含原子数相等
A
分析:相同条件下,气体的Vm相等,根据n= =
= 结合分子的组成判断.
结合分子的组成判断.
解答:A.在同温同压下,气体的Vm相等,由V=n×Vm可知,体积相等,故A正确;
B.由n= =
= 可知:ρ=
可知:ρ= =
=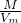 ,则密度与气体的相对分子质量呈正比,二者的相对分子质量不同,则密度不同,故B错误;
,则密度与气体的相对分子质量呈正比,二者的相对分子质量不同,则密度不同,故B错误;
C.由n= ,二者的摩尔质量不等,则质量不等,故C错误;
,二者的摩尔质量不等,则质量不等,故C错误;
D.由N=nNA知,相同物质的量时,气体的分子数相等,但原子数不等,故D错误.
故选A.
点评:本题考查阿伏加德罗定律及其推论,题目难度不大,注意相关物质的量的计算公式的运用.
分析:相同条件下,气体的Vm相等,根据n=
 =
= 结合分子的组成判断.
结合分子的组成判断.解答:A.在同温同压下,气体的Vm相等,由V=n×Vm可知,体积相等,故A正确;
B.由n=
 =
= 可知:ρ=
可知:ρ= =
=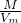 ,则密度与气体的相对分子质量呈正比,二者的相对分子质量不同,则密度不同,故B错误;
,则密度与气体的相对分子质量呈正比,二者的相对分子质量不同,则密度不同,故B错误;C.由n=
 ,二者的摩尔质量不等,则质量不等,故C错误;
,二者的摩尔质量不等,则质量不等,故C错误;D.由N=nNA知,相同物质的量时,气体的分子数相等,但原子数不等,故D错误.
故选A.
点评:本题考查阿伏加德罗定律及其推论,题目难度不大,注意相关物质的量的计算公式的运用.

练习册系列答案
相关题目


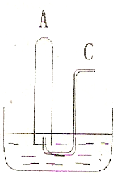 如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为________;通过导气管C往余下0.5a mL 气体的试管A中持续通人氧气,A 中可能观察到的现象是:________.当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为________mL,水槽B中溶液的物质的量浓度为________mol?L-1(设溶液的体积仍为500mL)
如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为________;通过导气管C往余下0.5a mL 气体的试管A中持续通人氧气,A 中可能观察到的现象是:________.当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为________mL,水槽B中溶液的物质的量浓度为________mol?L-1(设溶液的体积仍为500mL)



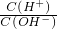 =1×1014的溶液:
=1×1014的溶液: .
.