题目内容
14.下列排列顺序不正确的是( )| A. | 离子半径:Mg2+>O2->F- | B. | 原子半径:Na>S>O | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
分析 A、核外电子排布相同的离子,核电荷数越大,离子半径越小;
B、同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
C、元素的非金属性越强,对应的氢化物越稳定;
D、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
解答 解:A、O2-、F-、Mg2+核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径:O2->F->Mg2+,故A错误;
B、同周期元素从左到右原子半径逐渐减小,则原子半径Na>S,一般来说,原子核外电子层数越多,原子半径越大,则Na>S>O,故B正确;
C、非金属性F>Cl>Br,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>HCl>HBr,故C正确;
D、非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:HClO4>H2SO4>H3PO4,故D正确;
故选A.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,为高考常见题型和高频考点,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
4.下列说法不正确的是( )
| A. | 冰→水若自发进行,△H<T△S | B. | 水→冰若自发进行,△H<0 | ||
| C. | 冰?水的平衡状态△H=T△S | D. | 水?冰的平衡状态,△H=0 |
2.海水中含有MgCl2,从海水中提取镁,正确的方法是( )
| A. | 海水$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{电解}{→}$Mg | |
| B. | 海水$\stackrel{HCl}{→}$MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg | |
| C. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 海水$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{BCl}{→}$ MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg |
9.下列含氧酸中酸性最强的是( )
| A. | H2SO4 | B. | HClO4 | C. | H3PO4 | D. | H2SeO4 |
19.下列粒子(分子或离子)均含有18个电子:
请回答下列问题:
(1)A的元素符号是K,B2-的结构示意图是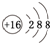 .
.
(2)C与D混合,发生反应的化学方程式为F2+2HCl═2HF+Cl2.
(3)E的电子式是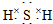 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2.
| 粒子 | A+ | B2- | C | D | E | F |
| 组成特点 | 单核离子 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
(1)A的元素符号是K,B2-的结构示意图是
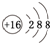 .
.(2)C与D混合,发生反应的化学方程式为F2+2HCl═2HF+Cl2.
(3)E的电子式是
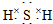 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2.
6.下列物质属于弱电解质的是( )
| A. | CH3COOH | B. | NaOH | C. | SO2 | D. | NH4Cl |
4.同主族元素形成的同一类化合物往往在结构和性质上很相似.化合物PH4I是一种白色晶体,则对PH4I的叙述不正确的是( )
| A. | 它可由PH3和HI化合而成 | |
| B. | 加热时PH4I可以分解,而且有颜色变化 | |
| C. | 它可以跟NaOH反应 | |
| D. | 它是一种共价化合物 |

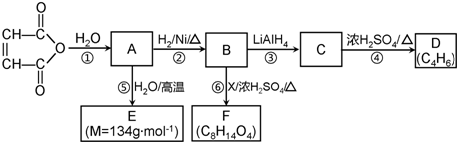

 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O. 、
、 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.