题目内容
10.下列废弃物处置方法不正确的是( )| A. | 将除铁锈后残余的稀硫酸倒入废液缸中 | |
| B. | 将制备氧气后残余的二氧化锰回收利用 | |
| C. | 将还原氧化铜后残余的一氧化碳点燃 | |
| D. | 将用剩的白磷溶解于CS2后倒入垃圾箱 |
分析 A、化学实验中的废液应该按照要求倒入指定的废液缸,不可随便倒入下水道中;
B、将制备氧气后残余的二氧化锰通过溶解过滤,然后回收利用;
C、一氧化碳有毒,可以将其转化为无毒的物质;
D、白磷的着火点较低,为40℃.
解答 解:A、将化学实验产生的废液应该倒入专门的废液缸中,进行妥善处理,不可随便的导入下水道中,故A正确;
B、将制备氧气后残余的二氧化锰通过溶解过滤,然后回收利用,故B正确;
C、一氧化碳有毒,可以将其转化为无毒的二氧化碳,故C正确;
D、白磷在空气中易自燃,用剩的白磷倒入垃圾箱会引发火灾,故D错误;
故选D.
点评 本题考查化学实验基本操作,题目难度不大,注意白磷在空气中易自燃.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.某温度下,反应H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=$\frac{9}{4}$.该温度下在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是( )
| 起始量 | 甲 | 乙 | 丙 |
| H2 (mol) | 1 | 2 | 2 |
| CO2(mol) | 1 | 1 | 2 |
| A. | 反应开始时,甲中的反应速率最慢,丙中的反应速率最快 | |
| B. | 平衡时,甲和丙中CO2的转化率相等,均是60% | |
| C. | 平衡时,乙中H2的转化率大于60% | |
| D. | 平衡时,丙中c(H2)是0.08 mol•L-1 |
15. 工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
反应Ⅰ2CO(g)+SO2(g)?2CO2(g)+S(1)△H1
(1)已知:反应Ⅱ2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应ⅢS(1)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1则△H1=-270KJ•mol-1.
(2)T℃时,起始将0.100mol CO(g)和0.120mol S02(g)充人2L恒容密闭容器中,发生反应Ⅰ,各物质的物质的量随时间变化如下表所示.
①下列事实能说明该反应达到化学平衡状态的是AC (填选项字母).
A.容器内压强不再改变 B.每消耗2mol C02,同时生成2mol CO
C.气体密度不再改变 D.v正( S02)=2v逆(C02)
②0~2min内,用CO表示的该反应的平均速率v(CO)=-7.5×10-3mol?L-1?min-1;平衡时,S02的转化率为25%.
③t℃时,反应I的平衡常数K=50.
④t℃时,若将上述气体充人起始容积为2L的恒压密闭容器中,反应达到平衡时,S02的转化率与原平衡相比增大.(填“增大”、“减小”或“不变”).
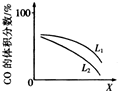
(3)L(L1、L2),X可分别代表压强或温度.如图表示t一定时,反应Ⅱ中CO(g)的体积分数随x的变化关系.
①X代表的物理量为压强.
②判断L1、L2的大小关系,并简述理由:L1>L2(或T1>T2),该反应正向为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大.
 工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.反应Ⅰ2CO(g)+SO2(g)?2CO2(g)+S(1)△H1
(1)已知:反应Ⅱ2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应ⅢS(1)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1则△H1=-270KJ•mol-1.
(2)T℃时,起始将0.100mol CO(g)和0.120mol S02(g)充人2L恒容密闭容器中,发生反应Ⅰ,各物质的物质的量随时间变化如下表所示.
| 时间/min 物质的量/mol 物质 | 0 | 2 | 4 | 6 | 8 | 10 |
| CO(g) | 0.100 | 0.070 | 0.050 | 0.044 | 0.040 | 0.040 |
| SO2(g) | 0.120 | 0.105 | 0.095 | 0.092 | 0.090 | 0.090 |
A.容器内压强不再改变 B.每消耗2mol C02,同时生成2mol CO
C.气体密度不再改变 D.v正( S02)=2v逆(C02)
②0~2min内,用CO表示的该反应的平均速率v(CO)=-7.5×10-3mol?L-1?min-1;平衡时,S02的转化率为25%.
③t℃时,反应I的平衡常数K=50.
④t℃时,若将上述气体充人起始容积为2L的恒压密闭容器中,反应达到平衡时,S02的转化率与原平衡相比增大.(填“增大”、“减小”或“不变”).
(3)L(L1、L2),X可分别代表压强或温度.如图表示t一定时,反应Ⅱ中CO(g)的体积分数随x的变化关系.
①X代表的物理量为压强.
②判断L1、L2的大小关系,并简述理由:L1>L2(或T1>T2),该反应正向为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大.
2.下列关于热化学方程式和反应的热效应的叙述中,正确的是( )
| A. | 已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?$?_{500℃,30MPa}^{催化剂}$2MH3(g),△H=-38.6kJ•mol-1 | |
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |
| D. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
20.下列实验装置图,其中关于用途的描述,不正确的是( )

| A. | 装置甲:用于制取并收集乙酸乙酯 | |
| B. | 装置乙:用于分离两种沸点不同的两种物质 | |
| C. | 装置丙:收集二氧化碳,从a口进气b口排气 | |
| D. | 装置丁:可用来制取氨气 |