题目内容
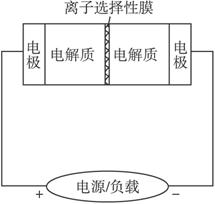
下图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr.

(1)左、右储罐中的电解质分别为:左
(2)写出电池充电时,阳极和阴极的电极反应式.
阳极:
阴极:
(3)写出电池充、放电的反应方程式:
(4)指出在充电过程中钠离子通过膜的流向:

(1)左、右储罐中的电解质分别为:左
NaBr3/NaBr
NaBr3/NaBr
,右Na2S2/Na2S4
Na2S2/Na2S4
.(2)写出电池充电时,阳极和阴极的电极反应式.
阳极:
3NaBr-2e-=NaBr3+2Na+(或3Br--2e-=Br3-)
3NaBr-2e-=NaBr3+2Na+(或3Br--2e-=Br3-)
,阴极:
Na2S4+2Na++2e-=2Na2S2(或S42-+2e-=2S22-)
Na2S4+2Na++2e-=2Na2S2(或S42-+2e-=2S22-)
.(3)写出电池充、放电的反应方程式:
2Na2S2+NaBr3
Na2S4+3NaBr
| 放电 |
| 充电 |
2Na2S2+NaBr3
Na2S4+3NaBr
.| 放电 |
| 充电 |
(4)指出在充电过程中钠离子通过膜的流向:
Na+的流向为从左到右
Na+的流向为从左到右
.分析:(1)左储罐为电源的正极,原电池正极发生还原反应,右储罐为电源的负极,原电池负极发生氧化反应,根据化合价的变化判断;
(2)电池充电时,阳极发生氧化反应,阴极发生还原反应;
(3)根据电极反应式判断;
(4)充电时,阳离子向阴极移动.
(2)电池充电时,阳极发生氧化反应,阴极发生还原反应;
(3)根据电极反应式判断;
(4)充电时,阳离子向阴极移动.
解答:解:(1)放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr,可知Na2S2→Na2S4被氧化,NaBr3→NaBr被还原,左储罐为电源的正极,原电池正极发生还原反应,则左储罐电解质为NaBr3/NaBr,右储罐为电源的负极,原电池负极发生氧化反应,则右储罐电解质为Na2S2/Na2S4,
故答案为:NaBr3/NaBr;Na2S2/Na2S4;
(2)电池充电时,阳极发生氧化反应,电极反应为3NaBr-2e-=NaBr3+2Na+(或3Br--2e-=Br3-),阴极发生还原反应,电极反应为Na2S4+2Na++2e-=2Na2S2(或S42-+2e-=2S22-),
故答案为:3NaBr-2e-=NaBr3+2Na+(或3Br--2e-=Br3-);Na2S4+2Na++2e-=2Na2S2(或S42-+2e-=2S22-);
(3)总反应为Na2S2和NaBr3生成Na2S4和NaBr的反应,电池充、放电的反应方程式为2Na2S2+NaBr3
Na2S4+3NaBr,
故答案为:2Na2S2+NaBr3
Na2S4+3NaBr;
(4)充电时,阳离子向阴极移动,应从左到右移动,故答案为:Na+的流向为从左到右.
故答案为:NaBr3/NaBr;Na2S2/Na2S4;
(2)电池充电时,阳极发生氧化反应,电极反应为3NaBr-2e-=NaBr3+2Na+(或3Br--2e-=Br3-),阴极发生还原反应,电极反应为Na2S4+2Na++2e-=2Na2S2(或S42-+2e-=2S22-),
故答案为:3NaBr-2e-=NaBr3+2Na+(或3Br--2e-=Br3-);Na2S4+2Na++2e-=2Na2S2(或S42-+2e-=2S22-);
(3)总反应为Na2S2和NaBr3生成Na2S4和NaBr的反应,电池充、放电的反应方程式为2Na2S2+NaBr3
| 放电 |
| 充电 |
故答案为:2Na2S2+NaBr3
| 放电 |
| 充电 |
(4)充电时,阳离子向阴极移动,应从左到右移动,故答案为:Na+的流向为从左到右.
点评:本题综合考查原电池和电解池知识,为高考常见题型,侧重于学生的分析能力的考查,难度较大,能正确写出电极反应式是该题的关键.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
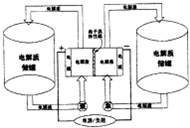 下图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2和NaIX(3≤x≤5),放电后,分别变为Na2S4和NaI.则下列说法不正确的是( )
下图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2和NaIX(3≤x≤5),放电后,分别变为Na2S4和NaI.则下列说法不正确的是( )