题目内容
7.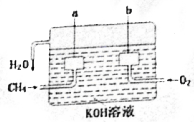 美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池.燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式.
美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池.燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式.(1)用KOH溶液做电解质,甲烷燃料电池的总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O;
(2)A是电池的负极,电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
(3)标准状况时,通入甲烷1.12L,理论上通过导线的电子的数目为2.408×1023.
分析 电池的电池反应式为:CH4+2O2+2KOH=K2CO3+3H2O,通入燃料甲烷的点极是负极,通入氧气的电极是正极,根据两电极上发生反应的反应类型确定反应的物质及电极反应式,并根据电极反应式结合电子转移情况计算.
解答 解:(1)燃料电池的总反应是燃料燃烧的反应,在碱性环境下,电池的电池反应式为:CH4+2O2+2KOH=K2CO3+3H2O,故答案为:CH4+2O2+2KOH=K2CO3+3H2O;
(2)通入燃料甲烷的电极a是负极,发生反应为:CH4-8e-+10OH-=CO32-+7H2O,故答案为:负;CH4-8e-+10OH-=CO32-+7H2O;
(3)标准状况时,通入甲烷1.12L即0.05mol,根据电极反应:CH4-8e-+10OH-=CO32-+7H2O,理论上通过导线的电子的数目为0.05mol×8×6.02×1023=2.408×1023,故答案为:2.408×1023.
点评 本题考查了燃料电池,电极反应式的书写要注意结合电解质溶液判断电极上的生成物,原料相同,电解质溶液不同,电极反应式就不同.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
17.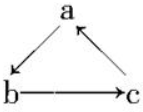 Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
 Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | NaOH | Al | Fe | Cu |
| b | Na | Al2O3 | FeCl3 | CuSO4 |
| c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
18.下列离子方程式书写错误的是( )
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- | |
| D. | Cl2与H2O反应:Cl2+H2O═H++Cl-+HClO |
2.温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )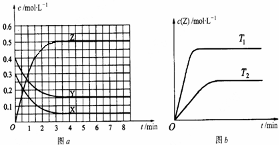

| A. | 该反应的正反应是放热反应 | |
| B. | T0时,该反应的平衡常数为$\frac{1}{3}$ | |
| C. | 反应时各物质的反应速率关系为:2v (X)=2v (Y)=v (Z) | |
| D. | 图a中反应达到平衡时,Y的转化率为37.5% |
19.下列说法正确的是( )
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液变红 | |
| B. | Na2O与Na2O2组成元素相同、阴阳离子个数比相同,但跟水反应的产物不同 | |
| C. | 只存在共价键的物质一定是共价化台物、离子化合物中一定含有离子键 | |
| D. | 元素原子的最外层电子数越多,得电子能力越强,失电子能力越弱 |
16.下列有机化合物的名称正确的是( )
| A. |  甘油 甘油 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. |  3-甲基-1-丁醇 3-甲基-1-丁醇 | D. |  石碳酸 石碳酸 |
17.88gCO2的物质的量是(已知C:12 O:16)( )
| A. | 4mol | B. | 5mol | C. | 1mol | D. | 2mol |
