题目内容
| ||

已知几种盐的溶解度随温度变化的曲线如下图所示:

回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是______.
(2)煅烧FeCO3生成产品I的化学反应方程式为______.实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有______.
(3)产品Ⅱ的化学式为______,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:______.
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,______.
(1)因Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,所以滤液中的主要溶质是硫酸亚铁,故答案为:Fe2+;
(2)因碳酸亚铁与氧气反应生成了氧化铁盒二氧化碳,4FeCO3+O2
2Fe2O3+4CO2;因实验室进行煅烧操作所需仪器有酒精灯、泥三角、三脚架、玻璃棒、坩埚、坩埚钳,
故答案为:4FeCO3+O2
2Fe2O3+4CO2; 坩埚、坩埚钳;
(3)硫酸铵与氯化钾反应生成硫酸钾和氯化铵;因硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,
故答案为:K2SO4;蒸发结晶、趁热过滤、洗涤、干燥;
(4)因检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,所以滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液,
故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液.
(2)因碳酸亚铁与氧气反应生成了氧化铁盒二氧化碳,4FeCO3+O2
| ||
故答案为:4FeCO3+O2
| ||
(3)硫酸铵与氯化钾反应生成硫酸钾和氯化铵;因硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,
故答案为:K2SO4;蒸发结晶、趁热过滤、洗涤、干燥;
(4)因检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,所以滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液,
故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
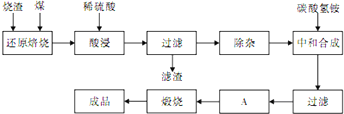
(1)焙烧时产生的主要有害气体是 .
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式: ;实验中所用酸性高锰酸钾溶液浓度为0.10mol/L,滤液用 滴定管量取20.00ml,用酸性高锰酸钾溶液滴定到终点时消耗了标准的酸性高锰酸钾溶液12.04ml,滤液中c(Fe2+)= .
(3)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是: (用离子方程式表示).
(4)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,检验Fe3+已经除尽的试剂是 (除KSCN外).
(5)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是 .

(1)焙烧时产生的主要有害气体是
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式:
(3)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:
(4)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 万全沉淀的pH | 4.77 | 3.68 | 9.61 |
(5)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是




