题目内容
 研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
①反应的热化学方程式为
②已知:C(s)+H2O(g)═CO(g)+H2(g)△H=+131kJ?mol-1
则C(s)+CO2(g)═2CO(g)△H=
(2)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知:N≡N键的键能是948.9kJ?mol-1,H-H键的键能是436.0kJ?mol-1; N-H键的键能是391.55kJ?mol-1.则1/2N2(g)+3/2H2(g)═NH3(g)△H=
考点:热化学方程式,反应热和焓变
专题:化学反应中的能量变化
分析:(1)①依据图象分析反应是放热反应,焓变为-41KJ/mol,依据热化学方程式的书写方法写出;
②依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)反应的焓变△H=反应物键能总和-生成物键能总和计算.
②依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)反应的焓变△H=反应物键能总和-生成物键能总和计算.
解答:
解:(1)①图象分析反应是放热反应,焓变为-41KJ/mol,标注物质狙击状态和对应反应焓变得到热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ?mol-1,故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ?mol-1;
②(1)CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ?mol-1;
(2)C(s)+H2O(g)═CO(g)+H2(g)△H=+131kJ?mol-1
依据盖斯定律(2)-(1)得到:C(s)+CO2(g)═2CO(g)△H═+172kJ/mol,
故答案为:+172kJ/mol;
(2)N≡N键的键能是948.9kJ?mol-1,H-H键的键能是436.0kJ?mol-1; N-H键的键能是391.55kJ?mol-1.则
N2(g)+
H2(g)═NH3(g);
△H=反应物键能总和-生成物键能总和=
×948.9kJ?mol-1 +
×436.0kJ?mol-1 -3×391.55kJ?mol-1=-46.2KJ/mol,
故答案为:-46.2 KJ/moL.
②(1)CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ?mol-1;
(2)C(s)+H2O(g)═CO(g)+H2(g)△H=+131kJ?mol-1
依据盖斯定律(2)-(1)得到:C(s)+CO2(g)═2CO(g)△H═+172kJ/mol,
故答案为:+172kJ/mol;
(2)N≡N键的键能是948.9kJ?mol-1,H-H键的键能是436.0kJ?mol-1; N-H键的键能是391.55kJ?mol-1.则
| 1 |
| 2 |
| 3 |
| 2 |
△H=反应物键能总和-生成物键能总和=
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:-46.2 KJ/moL.
点评:本题考查了热化学方程式书写方法和注意问题,注意键能计算焓变的方法,题目难度中等.

练习册系列答案
相关题目
在正规化学试卷的开始处总有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32 Cu:64等.请问这些数值准确的说法应该是( )
| A、某种核素的相对原子质量 |
| B、某种核素的近似相对原子质量 |
| C、某种元素的平均相对原子质量 |
| D、某种元素的平均相对原子质量的近似值 |
 将如图所示实验装置的K闭合,下列判断正确的是( )
将如图所示实验装置的K闭合,下列判断正确的是( )| A、电子沿Zn→a→b→Cu路径流动 |
| B、Cu电极上发生还原反应 |
| C、片刻后甲池中c(SO42-)增大 |
| D、片刻后可观察到滤纸b点变红色 |
下列操作错误的是( )(填序号)
| A、用蒸发皿进行加热蒸发实验时,不垫石棉网 |
| B、浓硫酸不慎沾到皮肤上,迅速用NaOH溶液清洗,再用水洗 |
| C、蒸馏时,将温度计水银球插入液面以下 |
| D、闻气体气味时,用手在容器口轻轻扇动,使少量气体飘入鼻孔中 |
| E、使用分液漏斗和容量瓶时,首先检查是否漏水 |
对实验Ⅰ~Ⅳ的实验现象判断正确的是( )
A、 实验Ⅰ:产生红褐色沉淀 |
B、 实验Ⅱ:试管中溶液变红色 |
C、 实验Ⅲ:试管中溶液变红色 实验Ⅲ:试管中溶液变红色 |
D、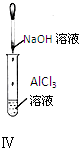 实验Ⅳ:试管中先出现白色沉淀,后溶解 |
 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体;C呈黄绿色;F是淡黄色的化合物;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;J能使湿润的红色石蕊试纸变蓝.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体;C呈黄绿色;F是淡黄色的化合物;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;J能使湿润的红色石蕊试纸变蓝.
