题目内容
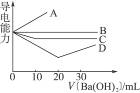
向20 mL 0.5 mol·L-1(NH4)2SO4溶液中逐滴加入0.5 mol·L-1 Ba(OH)2溶液,整个滴加过程中混合溶液的导电能力的变化基本符合下图中的( )
D 解析:溶液的导电能力的强弱与溶液中所含有的能自由移动的离子的浓度大小有关。 (NH4)2SO4和Ba(OH)2都是强电解质,在溶液中虽完全电离,但它们相互反应生成难电离的NH3·H2O和难溶的BaSO4,故滴加过程中,原溶液中的c(
![]() )和c(
)和c(![]() )均逐渐减小;当滴加Ba(OH)2溶液20 mL时,反应完全,离子浓度最小,溶液导电能力最弱;再继续滴加Ba(OH)2溶液,不再发生反应,随着Ba2+和OH-两种离子浓度的增大,溶液的导电能力逐渐增加。但由于后加入Ba(OH)2与原(NH4)2SO4的物质的量浓度相等(准确来说,应是电荷浓度相等),且受到恰好反应时所得40 mL稀氨水溶液的稀释,故最后得到溶液的导电能力应该比最初的20 mL 0.5 mol·L-1 (NH4)2SO4溶液的导电能力差。
)均逐渐减小;当滴加Ba(OH)2溶液20 mL时,反应完全,离子浓度最小,溶液导电能力最弱;再继续滴加Ba(OH)2溶液,不再发生反应,随着Ba2+和OH-两种离子浓度的增大,溶液的导电能力逐渐增加。但由于后加入Ba(OH)2与原(NH4)2SO4的物质的量浓度相等(准确来说,应是电荷浓度相等),且受到恰好反应时所得40 mL稀氨水溶液的稀释,故最后得到溶液的导电能力应该比最初的20 mL 0.5 mol·L-1 (NH4)2SO4溶液的导电能力差。 练习册系列答案
练习册系列答案
提优检测卷初中强化拓展系列答案
百渡中考必备中考试题精选系列答案
魅力语文系列答案
状元龙初中语文现代文阅读系列答案
初中现代文文言文拓展阅读系列答案
启光中考全程复习方案系列答案
授之以渔中考试题汇编系列答案
中考前沿系列答案
宇轩图书小学毕业升学系统总复习系列答案
动力源书系中考必备38套卷系列答案
相关题目