��Ŀ����
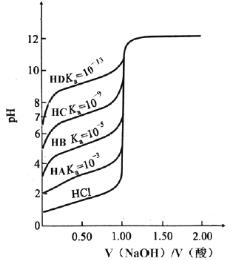
����Ŀ��C��N��S�������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ����IJ���Ӱ�졣
��1���ڴ������ڵ������£���H2��NO��ԭΪN2����֪��
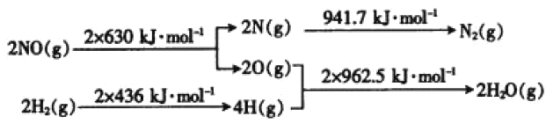
��������һ��������Ӧ���ɵ�����ˮ�������Ȼ�ѧ����ʽ��_____��
��2����500���ºϳɼ״��ķ�Ӧԭ��Ϊ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)��1L���ܱ������У�����1mol CO2��3mol H2��ѹǿΪp0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ����ѹ�����ʵ�������)
CH3OH(g)��H2O(g)��1L���ܱ������У�����1mol CO2��3mol H2��ѹǿΪp0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ����ѹ�����ʵ�������)
�ٷ�Ӧ���е�4minʱ��v(��)__v(��) (����>����<����������)��0��4min��H2��ƽ����Ӧ����v(H2)��_mol��L��1��min��1��
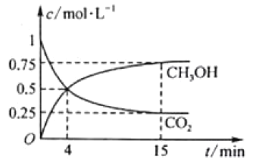
��CO2ƽ��ʱ���������Ϊ___�����¶���KpΪ__(�ú���p0��ʽ�ӱ�ʾ)��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����___��
A.v��(CH3OH)��3v��(H2)
B.CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1
C.���º�ѹ�£������������ٱ仯
D.���º����£�������ܶȲ��ٱ仯
��500�桢��2���ݻ�����2L���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | ������ | ������ |
��Ӧ����ʼͶ���� | 1mol CO2��3mol H2 | 0.5mol CO2��1mol H2 1mol CH3OH��1mol H2O |
CH3OH��ƽ��Ũ��/mol ��L��1 | C1 | C2 |
���������з�Ӧ��ʼ��___������У�c1___c2��(����>����<����������)
��3���״���Ϊһ��ȼ�ϻ�������ȼ�ϵ�ء����¶�Ϊ650���������ȼ�ϵ�����ü״���������CO2�Ļ����������Ӧ������缫����Li2CO3��Na2CO3�����������ʡ��õ�صĸ�����ӦʽΪ___��
���𰸡�2NO(g)+2H2 (g)=N2(g)+2H2O(g) ��H=��734.7kJ��mol-1 > 0.375 10% 256/(3p02 )��![]() C �淴Ӧ < CH3OH��6e��+3CO32��=4CO2��+2H2O
C �淴Ӧ < CH3OH��6e��+3CO32��=4CO2��+2H2O
��������
��1����H=��Ӧ���ܼ���-�������ܼ��ܣ�
��2���ٸ���4min��Ӧ������������ı仯ȷ����Ӧ������v=��c/��t����״���CO2�����ʣ��ٸ������ʱȵ��ڻ�ѧ������֮�ȼ��� H2��
�ڸ�������ʽ�����㣻
�۱������ڷ����ı䣬֤����Ӧ�ﵽ��ƽ�⣻
��������ʽ�����жϣ�
��3��ȼ���ڸ�����Ӧ��������������Ӧ����д�缫��Ӧʽ��
��1����H=��Ӧ���ܼ���-�������ܼ���=2��630KJ/mol+2��436KJ/mol-941.7 KJ/mol-2��962.5KJ/mol=-734.7kJ��mol-1���Ȼ�ѧ����ʽΪ2NO(g)+2H2 (g)=N2(g)+2H2O(g) ��H=��734.7kJ��mol-1��
�𰸣�2NO(g)+2H2 (g)=N2(g)+2H2O(g) ��H=��734.7kJ��mol-1
��2���ٷ�Ӧ���е�4min�״���Ũ���������ӣ�������̼Ũ�����ڼ�С��˵����Ӧ��������У���v(��) >v(��)��0��4min��v��CO2��=![]() =0.125 mol��L��1��min��1����H2��ƽ����Ӧ����v(H2)=3 v��CO2����3��0.125=0.375mol��L��1��min��1��
=0.125 mol��L��1��min��1����H2��ƽ����Ӧ����v(H2)=3 v��CO2����3��0.125=0.375mol��L��1��min��1��
�𰸣�> 0.375
�� CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
n������ 1 3 0 0
��n 0.75 0.75 0.75 0.75
n��ƽ�⣩0.25 0.75 0.75 0.75
CO2ƽ��ʱ���������Ϊ![]() =10%��ƽ������ѹǿΪ
=10%��ƽ������ѹǿΪ![]() P0=
P0=![]() ��CO2������ѹǿΪ
��CO2������ѹǿΪ![]() =0.0625P0���������״���ˮ����ƽ�������ʵ�����ȣ�ѹǿ��ȣ�ѹǿ��Ϊ
=0.0625P0���������״���ˮ����ƽ�������ʵ�����ȣ�ѹǿ��ȣ�ѹǿ��Ϊ![]()
![]() =0.1875P0��ƽ�ⳣ��ΪKp=
=0.1875P0��ƽ�ⳣ��ΪKp=![]() =
= ![]() ��256/(3p02 )��
��256/(3p02 )��
�𰸣�10% 256/(3p02 )��![]()
��A.���ʱȲ����ڻ�ѧ������֮�ȣ���A����
B.��Ӧ��CO2��H2��H2O��CH3OH�����ʵ���Ũ��֮�Ⱦ����ڷ�Ӧ��ʼʱ�������ʵĶ��٣���ƽ��״̬�أ���B����
C.��Ϊ����ӦΪ���������С�ķ�Ӧ�����º�ѹʱ����Ӧ�����������������ڼ�С���������������ٱ仯����ﵽƽ��״̬����C��ȷ��
D.���������غ㶨�ɣ���Ӧǰ�������������䣬��������䣬���ܶ�ʼ�ղ��䣬�����ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬����D����
�𰸣�C
���ȸ��ݢڼ���K
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
c������ 1 3 0 0
��c 0.75 0.75 0.75 0.75
c��ƽ�⣩ 0.25 0.75 0.75 0.75
k==![]() =
=![]()
�����ң�
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
c������ 0.25 1/2 0.5 0.5
Qc=![]() =8>k,��Ӧ�淴Ӧ������С�
=8>k,��Ӧ�淴Ӧ������С�
�������������ʼ���ʵ���ȫ����Ϊ��Ӧ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
n������ 0.5 1 1 1
�����n 1.5 4
�������з�Ӧ���Ũ�ȴ��������ף���ΪT��V��ͬ���������������ʵ�ƽ��Ũ�ȴ��ڼ����������ʵ�ƽ��Ũ�ȡ�
�𰸣��淴Ӧ <
��3���״�ȼ�ϵ���м״�ʧ���ӱ��������ڸ���������Ӧ���缫��ӦʽΪCH3OH+3CO32--6e-=4CO2+2H2O��
�𰸣� CH3OH+3CO32--6e-=4CO2+2H2O

 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�