题目内容
11.己知Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,请用Na2CO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程.必需的试剂有酚酞;操作和现象是取Na2CO3溶液少许于试管中,滴加酚酞显红色,加热后溶液红色加深.分析 碳酸根离子水解生成碳酸氢根离子和氢氧根离子,溶液显示碱性,可以选用酚酞作为指示剂,然后通入给碳酸钠溶液加热,根据溶液红色深浅判断温度对该平衡的影响.
解答 解:Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,所以Na2CO3溶液呈碱性,向溶液中滴加酚酞后,溶液变成红色,
加热后滴有酚酞的碳酸钠溶液的红色加深,证明碳酸钠的水解为吸热反应,加热后平衡CO32-+H2O?HCO3-+OH-向着正向移动,
故答案为:酚酞; 取Na2CO3溶液少许于试管中,滴加酚酞显红色,加热后溶液红色加深.
点评 本题考查了弱电解质电离、盐类水解,熟悉影响弱电解质电离的因素,平衡移动原理是解题关键,题目难度不大.

练习册系列答案
相关题目
1.下列关于反应过程中能量变化的说法正确的是( )


| A. | 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 |
6.用惰性电极电解下列物质的稀溶液,经过一段时间后,溶液的pH减小的是( )
| A. | Na2SO4 | B. | NaOH | C. | NaCl | D. | AgNO3 |
16.能表示人体大量喝水时,胃液的pH变化的是( )
| A. |  | B. |  | C. |  | D. |  |
3.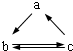 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( ) | a | b | c |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | Na2O2 | Na2CO3 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
20.聚四氟乙烯的耐热性和化学稳定性超过其他塑料,被称为“塑料王”.其合成路线如下:
三氯甲烷$\stackrel{HF、SbCl_{3}}{→}$二氟一氯甲烷$\stackrel{△}{→}$四氟乙烯$\stackrel{引发剂}{→}$聚四氟乙烯
下列说法中,不正确的是( )
三氯甲烷$\stackrel{HF、SbCl_{3}}{→}$二氟一氯甲烷$\stackrel{△}{→}$四氟乙烯$\stackrel{引发剂}{→}$聚四氟乙烯
下列说法中,不正确的是( )
| A. | “塑料王”聚四氟乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应来制取 | |
| C. | 四氟乙烯 (CF2=CF2)中所有的原子都在同一个平面上 | |
| D. | 四氟乙烯 (CF2=CF2)通过加聚反应生成“塑料王”聚四氟乙烯 |
1.氯化碘(ICl)的化学性质与氯气相似,预计它与水能反应,则下列说法正确的是( )
| A. | 生成物是HI和HClO | B. | 生成物是HCl和HIO | ||
| C. | 属于置换反应 | D. | 属于复分解反应 |
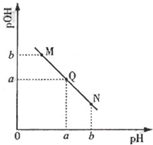 已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.
已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.