题目内容
3.下列各组金属最适合用H2或CO把它们从化合物中还原出来的是( )| A. | Na | B. | Al | C. | Fe | D. | Hg |
分析 金属的冶炼方法有电解法、热还原法、热分解法等,在金属活动顺序表中Zn~Cu等较不活泼金属可用热还原法冶炼,
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得;高熔点金属采用电解法来冶炼.
解答 解:A.钠为活泼金属,工业用电解法冶炼,故A不选;
B.Al为活泼金属,工业用电解法冶炼,一般用电解氧化铝的方法冶炼,故B不选;
C.Fe用CO还原法冶炼,故C选;
D.Hg为不活泼金属,可用热分解法冶炼,故D不选.
故选C.
点评 本题考查金属的冶炼,侧重于元素化合物知识的综合理解和运功的考查,题目难度不大,金属的冶炼方法与金属的活泼性有关,注意不同活泼性的金属的冶炼方法.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.(1)除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
(2)某芳香族化合物的分子式为C7H8O,根据下列实验现象写出相应的结构简式:(要求:每小题只需给出一个答案即可.)
①不能与金属钠反应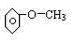 .
.
②能与钠反应,但遇FeCl3不显色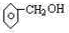 .
.
③能与钠反应且遇FeCl3显紫色 .
.
| 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 | |
| A | 苯(苯酚) | ||
| B | 乙酸乙酯(乙酸) | ||
| C | 乙烷(乙烯) |
①不能与金属钠反应
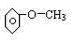 .
.②能与钠反应,但遇FeCl3不显色
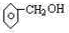 .
.③能与钠反应且遇FeCl3显紫色
 .
.
14.下列各组物质中互为同系物的是( )
| A. | O2与O3 | B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C | ||
| C. | CH4与CH3CH2CH3 | D. | CH3CH2CH2CH3与 |
11.下列各项表示正确的是( )
| A. | HCl的电子式: | B. | Cl-结构示意图: | ||
| C. | 乙醇的结构简式:C2H6O | D. | 乙烯的结构式:H-C=C-H |
8.有关晶体的下列说法中正确的是( )
| A. | 冰熔化时水分子中共价键发生断裂 | |
| B. | 原子晶体中共价键越强硬度越大 | |
| C. | 晶体中分子间作用力越大,分子越稳定 | |
| D. | 氯化钠溶于水时离子键未被破坏 |
15.下列常见的物质电离和提纯操作中,将液体蒸发为气体再冷凝为液体的操作是( )
| A. | 结晶 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
12.下列说法错误的是( )
| A. | 有机物只能来自于有生命力的动、植物 | |
| B. | 德国化学家维勒首次用无机物氰酸铵合成了有机物尿素 | |
| C. | 德国化学李比希最先提出有机物的定量分析方法 | |
| D. | 荷兰化学家范特霍夫最先提出CH2Cl2没有同分异构体 |
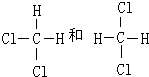
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.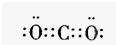 .
.