题目内容
下列叙述正确的是( )
| A、P4是非极性分子,磷原子处在正方形4个角上 |
| B、H2O是极性分子,氧原子不处在2个氢原子所连成的直线的中央 |
| C、CCl4是非极性分子,碳原子处在4个氯原子所组成的正方形的中心 |
| D、CO2是极性分子,碳原子处在2个氧原子所连成的直线的中央 |
| E、CO2是极性分子,碳原子处在2个氧原子所连成的直线的中央 |
考点:极性分子和非极性分子
专题:化学键与晶体结构
分析:A.P4具有正四面体结构( ),是非极性分子;
),是非极性分子;
B.H2O中含有极性键,空间结构为折线型,属于极性分子;
C.CCl4是非极性分子,所有原子根本不在同一平面内;
D.CO2是非极性分子,碳原子处在2个氧原子所连成的直线的中央.
 ),是非极性分子;
),是非极性分子;B.H2O中含有极性键,空间结构为折线型,属于极性分子;
C.CCl4是非极性分子,所有原子根本不在同一平面内;
D.CO2是非极性分子,碳原子处在2个氧原子所连成的直线的中央.
解答:
解:A.白磷分子无中心原子,根据共价键的方向性和饱和性,每个磷原子都以3个共价键与其他3个磷原子结合形成共价键,磷原子不是处在正方形4个角上,而是形成正四面体结构,是非极性分子,故A错误;
B.H2O分子的结构式为:H-O-H,O-H键为极性键,氧原子不处在2个氢原子所连成的直线的中央,空间结构为折线型,属于极性分子,故B正确;
C.CCl4结构对称,正负电荷重心重合,是非极性分子,形成正四面体结构,不是正方形,故C错误;
D.二氧化碳的分子结构为O=C=C,CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故D错误;
故选B.
B.H2O分子的结构式为:H-O-H,O-H键为极性键,氧原子不处在2个氢原子所连成的直线的中央,空间结构为折线型,属于极性分子,故B正确;
C.CCl4结构对称,正负电荷重心重合,是非极性分子,形成正四面体结构,不是正方形,故C错误;
D.二氧化碳的分子结构为O=C=C,CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故D错误;
故选B.
点评:本题考查极性分子和非极性分子以及分子空间构型的判断,题目难度不大,注意从分子结构是否对称判断分子的极性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、冰熔化时,分子中H-O键发生断裂 |
| B、HI比HF易分解,是因为HI分子间不存在氢键 |
| C、CO2与SiO2都属于分子晶体 |
| D、熔沸点由高到低的顺序是:金刚石>NaCl>Na |
下列有机反应中,不属于取代反应的是( )
A、CH3COOH+CH3CH2OH
| |||
B、2CH3CH2OH
| |||
C、CH3CH2OH
| |||
D、 +Br2 +Br2
 +HBr +HBr |
下列每组均有四种物质,按照某种分类标准,其中有一种物质与其他三种物质的类别不同,每组中选出的该物质能够化合生成一种盐类化合物.该化合物的化学式为( )
①O2、Cl2、NO2、Br2
②铜、硅、硫、钠;
③CH4、NH3、H2O、HCl;
④CuO、Fe2O3、CO2、Na2O.
①O2、Cl2、NO2、Br2
②铜、硅、硫、钠;
③CH4、NH3、H2O、HCl;
④CuO、Fe2O3、CO2、Na2O.
| A、NH4HCO3 |
| B、Na2SiO3?2H2O |
| C、Cu2 (OH) 2CO3 |
| D、FeSO4?7H2O |
下列关于葡萄糖的叙述,错误的是( )
| A、是白色晶体,能溶于水,有甜味 |
| B、是一种多羟基醛,有还原性 |
| C、能发生水解反应,生成酒精 |
| D、与果糖互为同分异构体 |
下列反应的离子方程式正确的是( )
| A、金属钠跟水反应 2Na+2H2O═2Na++2OH-+H2↑ |
| B、石灰水跟盐酸反应H++2OH-═H2O |
| C、碳酸钡溶于稀盐酸 BaCO3+2H+═Ba2++H2CO3 |
| D、氨气与氯化氢气体混和NH3+H+═NH4+ |
下列实验装置设计正确的是( )
A、 干燥氯气 |
B、 稀释浓硫酸 |
C、 实验室制氨气 |
D、 分馏石油 |
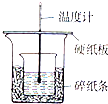 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题: