题目内容
17.某工厂的燃料煤中硫的质量分数为0.32%,该工厂每天燃烧这种煤10t,计算:(1)如果煤中的硫全部转化为SO2,每天可产生的SO2的质量为多少t;
(2)这些SO2在标准状况下的体积.
分析 (1)根据硫元素守恒计算;
(2)根据n=$\frac{m}{M}$计算二氧化硫物质的量,再根据V=nVm计算二氧化硫体积.
解答 解:(1)设每天可产生的SO2的质量为xt,根据硫元素守恒:
10t×0.32%=xt×$\frac{32}{64}$
解得x=0.064
答:每天可产生的SO2的质量为0.064吨;
(2)二氧化硫物质的量为$\frac{64000g}{64g/mol}$=1000mol,故二氧化硫的体积为1000mol×22.4L/mol=2.24×104L,
答:SO2在标准状况下的体积为2.24×104L.
点评 本题考查化学方程式计算,注意利用守恒法计算,难度不大,旨在考查学生对基础知识的巩固,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2 Fe2+ | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
12.利用右图实验装置,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 | 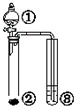 | |
| A. | 硫酸 | Na2SO3 | KMnO4 | SO2有漂白性 | |
| B. | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
| C. | H2O | 工业电石 | KMnO4 | 乙炔具有还原性 | |
| D. | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
9.研究物质的物理性质时,最常用到的方法是( )
| A. | 观察 | B. | 实验 | C. | 假说 | D. | 模型 |
6.下列画有横线的物质在反应中不能完全消耗的是( )
| A. | 将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃 | |
| B. | 将l mol Mg置于10 L空气(标况)中,使之在高温下反应 | |
| C. | 标准状况下,将11.2L H2S与22.4L O2混合点燃 | |
| D. | 在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2 |
 和一个-Cl,它的可能的结构有几种( )
和一个-Cl,它的可能的结构有几种( )