题目内容
【题目】A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率v(A)=__________,v(B)=_____________,v(C)=___________;该反应的化学反应方程式为___________________________。
【答案】0.1mol/( L· min) 0.2mol/( L· min) 0.3mol/( L· min) A+2B=3C
【解析】
v(A)=![]() =
=![]() =0.1mol/(L·min),v(B)=
=0.1mol/(L·min),v(B)=![]() =
=![]() =0.2mol/(L·min),v(C)=
=0.2mol/(L·min),v(C)=![]() =
=![]() =0.3mol/(L·min);由于Δc(A):Δc(B):Δc(C)=0.2mol/L:0.4mol/L:0.6mol/L=1:2:3,所以该反应的化学方程式为A+2B=3C。
=0.3mol/(L·min);由于Δc(A):Δc(B):Δc(C)=0.2mol/L:0.4mol/L:0.6mol/L=1:2:3,所以该反应的化学方程式为A+2B=3C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
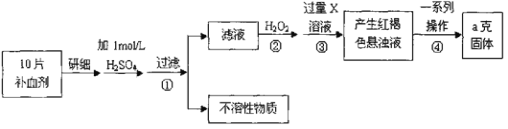
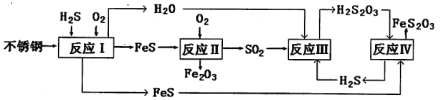
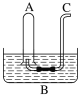
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓