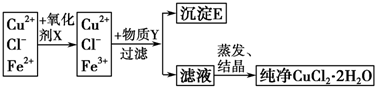
题目内容
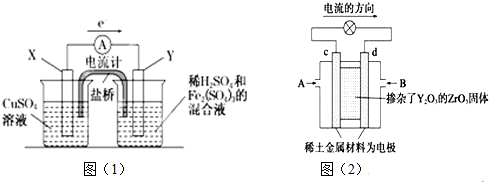
12. 已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )
已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2
锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S.
| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生还原反应 | |
| C. | 理论上两种电池的比能量相同 | |
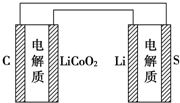
| D. | 如图表示用锂离子电池给锂硫电池充电 |
分析 A.原电池中阳离子向正极移动;
B.锂硫电池充电时,锂电极与外接电源的负极相连;
C.比能量是参与电极反应的单位质量的电极材料放出电能的大小;
D.给电池充电时,负极与外接电源的负极相连,正极与外接电源的正极相连.
解答 解:A.原电池中阳离子向正极移动,则锂离子电池放电时,Li+向正极迁移,故A错误;
B.锂硫电池充电时,锂电极与外接电源的负极相连,锂电极上Li+得电子发生还原反应,故B正确;
C.比能量是参与电极反应的单位质量的电极材料放出电能的大小,锂硫电池放电时负极为Li,锂离子电池放电时负极为LixC,两种电池的负极材料不同,所以比能量不同,故C错误;
D.图中表示锂硫电池给锂离子电池充电,右边电极材料是Li和S,锂负极,硫为正极,左边电极材料是C和LiCoO2,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe--xLi+=Li1-xCoO2;C为阴极得电子发生还原反应:
C+xe-+xLi+=LixC,则C与负极Li相连,LiCoO2应与正极S相连,故D错误;
故选B.
点评 本题考查了二次电池,为高频考点,侧重于对原电池原理和电解池原理的考查,题目难度中等,注意根据电池总反应判断正负极材料及电极反应.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
5.下列说法中正确的是( )
| A. | 酸性溶液中只存在H+,不存在0H-,只有中性溶液或纯水中既有H+又有OH- | |
| B. | 温度越高,KW越大,所以温度高的溶液中的c(H+)一定比温度低的溶液中的c(H+)大 | |
| C. | 水的电离平衡受酸、碱和温度等条件的影响 | |
| D. | 向水中加人碱时,由于加人的OH-与水电离产生的H+作用.使c(H+)减小,平衡向电离的方向移动. |
7.可逆反应发生下列变化,平衡一定正向移动的是( )
| A. | 正反应速率增大 | B. | 反应物浓度减小 | ||
| C. | K值减小 | D. | 正反应速率大于逆反应速率 |
17.有文献报道,硫在空气中燃烧时,产物中SO3约占5%~6%(体积比,下同),而硫在纯氧气中燃烧时,其产物中的SO3约占2%~3%,解释这一事实的理由正确的是( )
| A. | 在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 | |
| B. | 在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 | |
| C. | 在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 | |
| D. | 没有使用催化剂 |
1.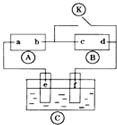 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通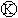 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
 如图
如图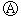 为直流电源,
为直流电源,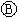 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,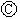 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. |  中电解质溶液为FeCl3 中电解质溶液为FeCl3 | ||
| C. | f电极为锌板 | D. | c极发生的反应为2H++2e-═H2↑ |
2.近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表
①请结合上表数据,写出NO与活性炭反应的化学方程式C+2NO?N2+CO2.
②上述反应的平衡常数表达式K=$\frac{c({N}_{2}).c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是c.
A.T1>T2 B.T1<T2 C.无法比较
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示:
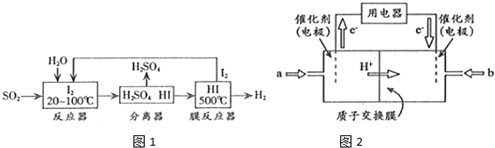
①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表
物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应的平衡常数表达式K=$\frac{c({N}_{2}).c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是c.
A.T1>T2 B.T1<T2 C.无法比较
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示:

①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示.
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.