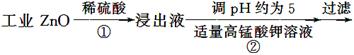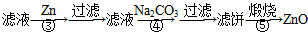题目内容
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5?H2O,硼砂的化学式为Na2B4O7?10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为 ,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
(1)+3(2分) B4O72-+2H++5H2O= 4H3BO3(2分)Mg+B2O3===2B+3MgO(2分)
(2)防止MgCl2水解生成Mg(OH)2(2分)
2H2O+Mg2++2e-= H2↑+Mg(OH)2↓(2分)
(3)H2O2+2H++2e-=2H2O(2分) 0.045 mol·L-1(2分) 没有(2分)
(4)碱式(2分) 99%(2分)
解析试题分析:(1)根据硼砂的化学式Na2B4O7?10H2O和化合价的代数和为0,可得B的化合价为+3;B4O72-与2H+反应可得H3BO3,离子方程式为:B4O72-+2H++5H2O= 4H3BO3;X为H3BO3晶体加热脱水的产物,为B2O3,与Mg发生氧化还原反应,化学方程式为:Mg+B2O3===2B+3MgO。
(2)MgCl2为强酸弱碱盐,能发生水解反应,所以MgCl2·7H2O在HCl氛围中加热的目的是:防止MgCl2水解生成Mg(OH)2;用惰性电极电解MgCl2溶液,阴极反应为H2O电离出的H+放电,电解方程式为:2H2O+Mg2++2e-= H2↑+Mg(OH)2↓
(3)镁-H2O2酸性燃料电池的正极为H2O2放电,电极方程式为:H2O2+2H++2e-=2H2O;起始电解质溶液pH=1,pH=2时反应的H+为:0.1mol?L?1—0.01mol?L?1=0.09mol?L?1,根据Mg+H2O2+2H+==Mg2++2H2O,可得Mg2+离子浓度为0.045 mol·L-1;溶液pH=6时,c(OH?)=10-8mol?L?1,Q [Mg(OH)2]=" 0.045" mol·L-1×[10-8mol?L?1]2=4.5×10-18 < Ksp[Mg(OH)2],所以没有Mg(OH)2沉淀析出。
(4)Na2S2O3为强碱弱酸盐,水解显碱性,所以Na2S2O3溶液应盛放在碱式滴定管内;根据元素守恒和离子方程式可得:2B ~ 2BI3 ~ 3I2 ~ 6 S2O32-,所以粗硼样品的纯度为:0.018L×0.30mol?L?1×1/3×11g/mol÷×100% = 99%
考点:本题考查化学工艺流程的分析、化学方程式、离子方程式和电解方程式的书写、盐类的水解、原电池和电解池原理、滴定管的使用、化学计算。

用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
(一定条件下,MnO4 - 可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2S04溶解A1203的离子方程式是
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:( Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的: ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式: ;
③Ⅲ中加入MnS04的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 。(填化学式)
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有________,溶液中肯定存在的离子是____。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)_____。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是 。
(3)反应Ⅱ的离子方程式为 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为 。
A.22.1 g B.27.2 g C.30 g D.无法确定
苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下:
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 |  |  | 易溶 |
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 (填“上”或“下”)层;实验操作的名称是 。
(2)步骤②用浓盐酸酸化的目的是 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 。
(5)重结晶时需要趁热过滤,目的是 。