题目内容
离子方程式:Al3++3AlOA.向铝盐溶液中加入NaOH溶液至过量
B.向NaOH溶液中加入铝盐溶液至过量
C.向铝盐溶液中加入小苏打至过量
D.向铝盐溶液中不断通入氨气
解析:A中反应过程为:Al3++3OH-===Al(OH)3↓,
Al(OH)3+OH-===AlO![]() +2H2O;B中反应过程为:Al3++4OH-===AlO
+2H2O;B中反应过程为:Al3++4OH-===AlO![]() +2H2O,
+2H2O,
Al3++3AlO![]() +6H2O===4Al(OH)3↓;C中反应过程为:Al3++3HCO
+6H2O===4Al(OH)3↓;C中反应过程为:Al3++3HCO![]() ===Al(OH)3↓+3CO2↑;D中反应过程为:Al3++3NH3·H2O===Al(OH)3↓+3NH
===Al(OH)3↓+3CO2↑;D中反应过程为:Al3++3NH3·H2O===Al(OH)3↓+3NH![]() 。
。
答案:B

练习册系列答案
相关题目
 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为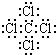
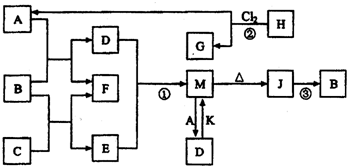
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.