题目内容
14.下列实验现象描述正确的是( )| A. | FeCl3溶液中滴入KSCN溶液,溶液呈蓝色 | |
| B. | 往氯化铁溶液中滴加氢氧化钠溶液,产生白色沉淀 | |
| C. | 氨气遇到湿润的红色石蕊试纸变蓝 | |
| D. | NaOH溶液中滴入酚酞试液,溶液呈无色 |
分析 A.铁离子与硫氰根离子结合生成硫氰化铁,溶液呈红色;
B.生成的氢氧化铁为红褐色沉淀;
C.氨气为碱性气体,能够使湿润的红色石蕊试纸变蓝;
D.酚酞中滴入碱溶液呈红色.
解答 解:A.FeCl3溶液中滴入KSCN溶液,溶液呈红色,据此可检验铁离子,故A错误;
B.往氯化铁溶液中滴加氢氧化钠溶液,产生红褐色的氢氧化铁沉淀,故B错误;
C.氨气与水结合生成一水合氨,呈碱性,所以氨气遇到湿润的红色石蕊试纸变蓝,故C正确;
D.NaOH溶液中滴入酚酞试液,溶液呈红色,故D错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,涉及离子检验、酸碱指示剂的使用、铁及其化合物性质等知识,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 100g质量分数为98%的浓硫酸中所含有的氧原子数为4NA | |
| C. | NA个H2分子与NA个D2O分子的质量比为1:9 | |
| D. | 标准状况下,5.6g乙烯和丙烯的混合气体中含C-H键的数目为0.8NA |
2.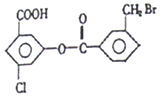 某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
充分反应后最多可消耗氢氧化钠的物质的量为( )
 某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |
9.下列对有机物的理解错误的是( )
| A. | 碳链是直链的烃,其含氢量是碳原子数相同的烃中最大的 | |
| B. | 相对分子质量越大的烷烃,其密度可能越大 | |
| C. | 有机物在空气中充分燃烧,各元素的最终产物分别是C→CO2,H→H2O | |
| D. | 在控制反应物和产物均为气态的条件下,分子中氢原子数为4的烃,燃烧反应前后体积不变 |
19.下列物质属于电解质的是( )
| A. | 氯水 | B. | 葡萄糖 | C. | 水银 | D. | 胆矾 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 用100mL4mol•L-1盐酸与8.7gMnO2共热能制取氯气0.1NA | |
| B. | 6.0gSiO2晶体中含有的硅氧键数目为0.4NA | |
| C. | 300mL2mol•L-1酒精水溶液中所含分子数为0.6NA | |
| D. | 标准状况下,22.4L氯气参与反应时转移的电子数一定为2NA |
3.如图所示装置,可用于实验室中( )


| A. | 加热NaHCO3固体制CO2 | B. | 实验室制取Cl2 | ||
| C. | 用Cu和稀HNO3反应制NO | D. | 用NH4Cl与浓NaOH溶液反应制NH3 |
18.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式为  | B. | 丙烷分子的球棍模型为 | ||
| C. | 四氯化碳分子的电子式为: | D. | 苯的最简式为C6H6 |
