题目内容
11.将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000mL、物质的量浓度为2mol/L,密度为1.20g/cm3的稀硫酸,求:(1)原浓硫酸的物质的量浓度;
(2)所需浓硫酸的体积;
(3)与Na2C03充分反应产生5.6L(标况)CO2,则需要该稀溶液的体积.
分析 (1)根据c=$\frac{1000ρω}{M}$计算该浓硫酸的物质的量浓度;
(2)根据稀释定律,稀释前后溶质的物质的量不变,据此计算需要浓硫酸的体积;
(3)5.6L(标况)CO2的物质的量n=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据1molH2SO4 ~1molCO2来分析计算.
解答 解:(1)密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
答:原浓硫酸的物质的量浓度为18.4mol/L;
(2)设需要浓硫酸的体积为VmL,根据稀释定律,稀释前后溶质的物质的量不变,则:
VmL×18.4mol/L=1000mL×2mol/L
解得V=108.7
答:所需浓硫酸的体积为108.7mL;
(3)5.6L(标况)CO2的物质的量n=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据硫酸与Na2C03反应时,1molH2SO4 ~1molCO2可知:生成0.25mol二氧化碳需0.25molH2SO4,设需要的物质的量浓度为2mol/L的硫酸的体积为VmL,则有:2mol/L×VmL×10-3=0.25mol
解得V=125mL.
答:需要的硫酸的体积为125mL.
点评 本题考查物质的量浓度有关计算,难度不大,注意掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
19.下列条件下,两种气体的分子数一定不相等的是( )
| A. | 相同质量、不同密度的N2O和CO2 | |
| B. | 相同体积、相同密度的CO和C2H4 | |
| C. | 相同温度、相同压强、相同体积的O2和N2 | |
| D. | 相同压强、相同体积、相同质量的NO2和N2O5 |
6.常温下,实验测得下列四种物质的pH如图所示,下列说法错误的是( )


| A. | 苹果汁的c(H+)=0.3mol•L-1 | B. | 生理盐水是一种中性溶液 | ||
| C. | 石灰水的碱性比肥皂水强 | D. | 石灰水与苹果汁能发生中和反应 |
16.下列各组离子方程式正确的是( )
| A. | Cu(OH)2与稀HNO3混合:OH-+H+═H2O | |
| B. | CaCl2与Na2CO3反应:Ca2++CO32-═CaCO3↓ | |
| C. | MgSO4与Ba(OH)2溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | Fe2O3溶于稀HNO3:Fe2O3+6H+═2Fe3++3H2O |
3.与1L 0.1 mol•L-1 的Na2CO3溶液中含有的钠离子个数相等的是( )
| A. | 6.02×1022个Na+ | B. | 0.1mol NaCl | ||
| C. | 1L 0.1mol•L-1 Na0H溶液 | D. | 28.6g Na2CO3•10H20 |
9.下列叙述正确的是( )
| A. | 元素性质呈周期性变化的根本原因是元素原子半径大小呈周期性变化 | |
| B. | 碘单质溶于酒精时,共价键被破坏 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
 的单体是:
的单体是: .
. 的单体是:CH3CH=CH2、CH2=CH2.
的单体是:CH3CH=CH2、CH2=CH2.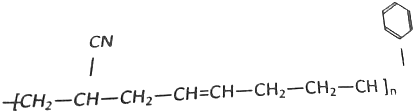 合成此高分子化合物用了三种单体,这三种单体的结构简式分别是CH2=CH-CN、CH2=CH-CH=CH2、
合成此高分子化合物用了三种单体,这三种单体的结构简式分别是CH2=CH-CN、CH2=CH-CH=CH2、 .
.